Kps adalah akronim yang digunakan untuk mewakili konstanta hasil kali kelarutan, yang mengacu pada produk (perkalian) dari konsentrasi dalam jumlah materi dari ion-ion yang ada dalam larutan.
Setiap kali zat terlarut yang kurang larut ditambahkan ke pelarut seperti barium sulfat, sejumlah kecil bagian dari garam ini larut dalam air, dan sisanya terakumulasi di dasar wadah, membentuk tubuh Latar Belakang. Garam yang larut menderita disosiasi, melepaskan kation dan anion ke dalam air.

Endapan hadir dalam larutan dengan air dan barium sulfat
Selain itu garamnya tidak enak kelarutan, jumlah zat terlarut tidak berubah dari waktu ke waktu karena ada keseimbangan pelarutan antara ion garam (ada dalam larutan) dan tubuh latar belakang.

Neraca Disolusi BaSO4 dalam air
Kps zat terlarut
HAI Kps zat terlarut adalah produk dari konsentrasi molar ion yang berpartisipasi. Itu selalu diperlukan untuk menaikkan konsentrasi ion ke koefisien stoikiometrinya masing-masing (digunakan untuk menyeimbangkan persamaan).

Kesetimbangan pelarutan elektrolit YItuXB
HAI Kps keseimbangan yang diusulkan untuk garam YItuXB itu akan memiliki konsentrasi reagen Y (dibesarkan ke koefisien stoikiometriknya (a) dan konsentrasi produk X (dinaikkan ke koefisien stoikiometriknya (b)).
Kps = [Y+b]Itu.[X-Itu]B
Contoh
Misalkan kita sedang menyiapkan larutan dengan air dan aluminium sianida [Al(CN)3], yang merupakan garam yang praktis tidak larut dalam air. Ketika garam ini ditambahkan ke air, ia akhirnya mengalami fenomena disosiasi.

Kesetimbangan disolusi elektrolit Al (CN)3
Jadi, melalui persamaan kesetimbangan pelarutan garam, kita dapatkan bahwa Kps akan memiliki perkalian konsentrasi kation aluminium (Al+3) dinaikkan menjadi eksponen 1 dengan konsentrasi anion sianida (CN-1) dinaikkan ke eksponen 3.
Kps = [Al+3]1.[CN-1]3
Kps arti dari zat terlarut
Ketika kita menemukan Kps dari garam tertentu yang dicampur dengan air, kita juga mengetahui konsentrasi masing-masing ion dalam larutan. Dengan data ini, kita dapat menentukan peringkat suatu larutan atau perilaku zat terlarut dalam larutan tersebut. Perhatikan keseimbangan berikut:

Kesetimbangan pelarutan elektrolit YItuXB
Kita dapat membuat hubungan berikut:
Jika Kps = [Y+b]Itu.[X-Itu]B = 0, kita memiliki larutan jenuh tanpa adanya endapan;
Jika Kps > [Y+b]Itu.[X-Itu]B = 0, kita memiliki larutan tak jenuh, yaitu sejumlah kecil zat terlarut yang dilarutkan dalam pelarut (dalam kaitannya dengan koefisien kelarutan);
Jika Kps < [Y+b]Itu.[X-Itu]B = 0, kami memiliki larutan jenuh dengan tubuh bagian bawah, yaitu, akan ada pengendapan elektrolit (zat terlarut);
Jika nilai Kps elektrolit terlalu rendah, itu adalah bahan yang sukar larut dalam pelarut.
Contoh perhitungan kps dari suatu zat terlarut
(URN): Kelarutan kalsium nitrat [Ca (NO .)3)2] dalam air adalah 2.0. 10–3 mol/liter pada suhu tertentu. Kps garam ini pada suhu yang sama adalah:
a) 8.10–8.
b) 8.10–10.
c) 3.2.10–10
d) 3.2.10–8
Data latihan:
Rumus garam: Ca (NO3)2;
Konsentrasi garam molar (kelarutan): 2.0. 10–3 perempuan jalang.
Untuk menyelesaikan dan menghitung Kps, Anda perlu melakukan hal berikut:
Langkah 1: Mengatur keseimbangan disolusi garam.
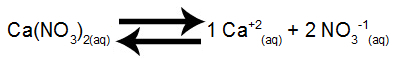
Kesetimbangan disolusi kalsium nitrat dalam air
Kalsium nitrat, ketika mengalami disosiasi dalam air, melepaskan 1 mol kation kalsium (Ca+2) dan 2 mol anion nitrat (NO3-1).
Langkah 2: Merakit ekspresi Kps garam
Kps garam ini akan menjadi produk dari konsentrasi kation kalsium yang dinaikkan ke eksponen 1 dengan konsentrasi anion nitrat yang dinaikkan ke eksponen 2, seperti yang ditunjukkan di bawah ini:
Kps = [Ca+2]1.[PADA3-1]2
Langkah 3: Tentukan nilai konsentrasi ion dalam larutan
Untuk menghitung Kps, kita memerlukan nilai konsentrasi ion, namun latihan memberikan molaritas garam dalam larutan. Untuk menentukan konsentrasi setiap ion, cukup kalikan molaritas garam dengan koefisien stoikiometri peserta dalam reaksi:
Untuk kation kalsium:
[Sini+2] = 1. 2,0. 10–3
[Sini+2] = 2,0. 10–3 perempuan jalang
Untuk anion nitrat:
[PADA3-1] = 2. 2,0. 10–3
[PADA3-1] = 4,0. 10–3 perempuan jalang
Langkah 4: Gunakan nilai konsentrasi yang ditemukan pada langkah 3 dalam ekspresi Kps (ditentukan pada langkah 2).
Kps = [Ca+2]1.[PADA3-1]2
Kps = [2.10-3]1.[4.10-3]2
Kps = 2.10-3.16.10-6
Kps = 32,10-9
atau
Kps = 3.2.10-9 (bln/L)
Oleh Saya Diogo Lopes Dias
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kps.htm

