Beberapa logam tidak ditemukan bebas di alam dan harus diperoleh melalui prosedur laboratorium. Salah satu metode pemurnian logam yang efektif dan ekonomis adalah melalui Elektrolisis. Elektrolisis terjadi dalam sel elektrolitik, dengan dua elektroda terhubung ke terminal generator arus searah.
Diketahui bahwa dalam sel elektrolisis terdapat katoda dan anoda, lihat definisi masing-masing:
Katoda: Elektroda negatif lah yang menarik kation, dan disinilah terjadi reduksi kation.
anoda: Elektroda positif yang menarik anion dan, oleh karena itu, di sinilah anion teroksidasi.
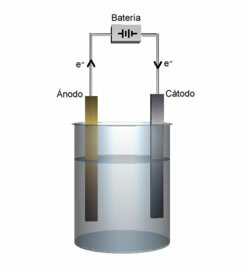
Demonstrasi anoda dan katoda.
Pemurnian Tembaga
Tembaga seperti yang ditemukan di alam memiliki kotoran seperti perak, besi, emas, seng. Melalui elektrolisis dimungkinkan untuk mengisolasi logam ini untuk memperolehnya dalam bentuk murni, ikuti prosesnya:
- Tembaga tidak murni berfungsi sebagai anoda dan larutan tembaga sulfat dalam air berfungsi sebagai elektrolit, yang berada di dalam sel elektrolit. Katoda sel adalah Tembaga itu sendiri dalam tingkat kemurnian yang tinggi.
- Tembaga ditransfer dari anoda ke katoda sementara pengotor tetap dalam larutan. Tembaga dalam keadaan murni terakumulasi di katoda dan dengan demikian dapat digunakan.
Oleh Liria Alves
Lulus kimia
Tim Sekolah Brasil
Lihat lebih banyak!
Reaksi Elektrolisis
Produk Elektrolisis
Elektrolisa - Fisikokimia - Kimia - Sekolah Brasil
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/purificacao-metais-atraves-eletrolise.htm

