Isomerisme itu adalah fenomena alam di mana zat yang berbeda (dalam hal sifat kimia dan fisik) memiliki rumus molekul yang persis sama, seperti pada contoh berikut:
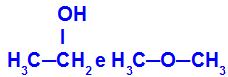
Zat yang berbeda yang memiliki rumus molekul yang sama
Etanol (kiri) memiliki rumus molekul C2H6O, yang juga terjadi dengan metoksietana (kanan), jadi mereka adalah isomer.
Jenis Isomerisme
→ isomer datar
Ini adalah jenis isomerisme yang mempelajari perbedaan struktural antara isomer.
Itu) Pendudukan
Ini adalah jenis isomerisme datar di mana perbedaan antara zat didasarkan pada perbedaan antara fungsi organik tempat mereka berasal. Lihat beberapa contoh:
Propanon dan propana:
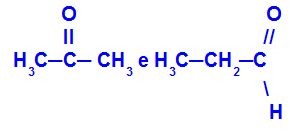
Isomer milik fungsi yang berbeda
Propanon (kiri) termasuk dalam kelompok keton, dan propanal (kanan) termasuk dalam kelompok aldehida.
B) Penjara
Ini adalah jenis isomerisme datar di mana perbedaan antara zat didasarkan pada perbedaan antara rantai yang ada. Lihat contoh:
2-metil-propana dan butana
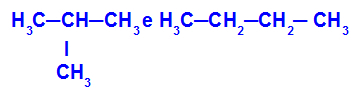
Isomer yang memiliki rantai dengan klasifikasi yang berbeda
Dalam contoh, kita dapat melihat bahwa 2-metil-propana (di sebelah kiri) memiliki rantai bercabang, dan butana (di sebelah kanan) memiliki rantai normal.
) Posisi
Ini adalah jenis isomerisme datar di mana perbedaan antara zat didasarkan pada perbedaan posisi komponen yang ada dalam rantainya. Lihat contoh:
1-kloro-propana dan 2-kloro-propana
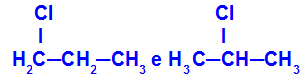
Isomer yang memiliki komponen pada posisi berbeda dalam rantai
Dalam contoh, kita dapat melihat bahwa 1-kloro-propana (di sebelah kiri) memiliki klorin yang ditempatkan pada karbon 1, dan 2-kloro-propana (di sebelah kanan) memiliki klorin yang ditempatkan pada karbon 2.
d) Metameria atau kompensasi
CATATAN: Isomerisme berlaku secara eksklusif untuk string heterogen.
Ini adalah jenis isomerisme datar di mana perbedaan antara zat didasarkan pada perbedaan posisi heteroatom yang ada dalam rantainya. Lihat contoh:
Contoh: Metoksipropana dan Etoksietana
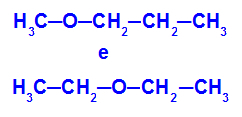
Isomer yang memiliki heteroatom pada posisi berbeda dalam rantai
Dalam contoh, kita dapat melihat bahwa, dalam metoksipropana (kiri), oksigen memiliki radikal dengan satu karbon di satu sisi dan tiga karbon di sisi lain. Dalam etoksietana (kanan), oksigen memiliki radikal dengan dua karbon di satu sisi dan dua karbon di sisi lain.
dan)Tautomeri
Ini adalah kasus khusus dari isomerisme fungsi bidang dan hanya terjadi pada tiga fungsi organik:
Aldehid
keton
enol
Jenis isomerisme ini bekerja berdasarkan fakta bahwa ada keseimbangan kimia antara enol dan aldehida dan antara enol dan keton, yaitu, komponen-komponen ini terus-menerus berubah menjadi satu sama lain. Lihat contoh:
Prop-2-en-1-ol dan propanon
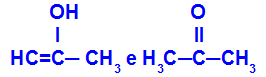
Isomer milik fungsi yang berbeda
Pada contoh, kita dapat melihat bahwa Prop-2-en-1-ol (di sebelah kiri) termasuk dalam kelompok enol, dan propanon (di sebelah kanan) termasuk dalam kelompok keton, sehingga merupakan isomer dari tautomer.
→ Isomerisme Luar Angkasa
Ini adalah jenis isomerisme yang ditentukan oleh analisis spasial molekul.
a) Isomer geometris
Jangan berhenti sekarang... Ada lagi setelah iklan ;)
Ini adalah jenis isomerisme spasial yang terjadi ketika zat tersebut memiliki molekul dengan karakteristik sebagai berikut:
Rantai tertutup yang memiliki dua karbon dengan dua ligan yang berbeda, seperti pada contoh di bawah ini:

Struktur tertutup dengan isomerisme geometris
Rantai terbuka yang memiliki ikatan rangkap antara karbon dan, pada masing-masing karbon ikatan rangkap tersebut, terdapat dua ligan yang berbeda, seperti pada contoh di bawah ini:
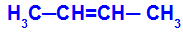
Struktur terbuka dengan isomerisme geometris
Isomerisme geometris dibagi menjadi dua kelompok:
1HAI Kelompok: cis-trans
Itu terjadi ketika dua ligan dari satu karbon benar-benar sama dengan dua ligan dari karbon lainnya, baik dalam struktur terbuka atau dalam struktur tertutup.
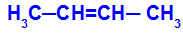
Rantai zat yang memiliki isomerisme cis-transtrans
Isomer akan disebut cis ketika ligan yang sama berada pada bidang yang sama.

Contoh isomer cis
Isomer akan disebut trans ketika ligan yang berbeda berada pada bidang yang sama.

Contoh isomer trans
2HAI Kelompok: E-Z
Itu terjadi ketika dua ligan dari satu karbon berbeda dalam kaitannya dengan dua ligan dari karbon lainnya, baik dalam struktur terbuka atau dalam struktur tertutup.

Rantai suatu zat yang memiliki isomerisme E-Z
Isomer akan disebut E ketika ligan dengan nomor atom tertinggi berada di bidang yang berlawanan. Pada contoh di bawah, karbon di sebelah kiri memiliki Br dengan nomor atom tertinggi (35) dan, di sisi lain, ada oksigen (8).
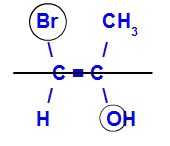
Contoh E-isomer
Isomer akan disebut Z ketika ligan dengan nomor atom tertinggi berada pada bidang yang sama. Pada contoh di bawah, karbon di sebelah kiri memiliki Br dengan nomor atom tertinggi (35) dan, di sisi lain, ada oksigen (8).

Contoh isomer Z
B) isomer optik
Ini adalah jenis isomerisme spasial yang hanya terjadi jika zat tersebut memiliki molekul dengan karbon kiral (yang memiliki empat ligan berbeda) dalam strukturnya. Molekul dengan karbon kiral memiliki kemampuan untuk mempolarisasi dan membelokkan cahaya, sebagai berikut:
Ke kanan (isomer tangan kanan)
Ke kiri (isomer levorotatory)
Senyawa dengan aktivitas optik selalu memiliki isomer aktif (disebut antipoda optik) dan isomer tidak aktif (campuran antara dua isomer aktif, campuran yang disebut rasemat).
Kita dapat menggunakan rumus berikut untuk menentukan jumlah isomer aktif (IOA) dan tidak aktif (IOI) dari senyawa yang memiliki karbon kiral:
IOA = 2tidak
IOI = 2tidak
2
Di bawah ini adalah contoh senyawa yang memiliki isomerisme geometris:
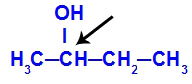
Karbon kiral ditampilkan dalam butan-2-ol
Struktur butan-2-ol memiliki ligan berikut:
Metil (CH3)
Etil (CH3-CH2)
Hidrogen (H)
Hidroksil (OH)
Karena hanya memiliki satu karbon kiral, maka butan-2-ol memiliki:
Isomer aktif:
IOA = 21
IOA = 2
Isomer tidak aktif:
IOI = 21
2
IOI = 2
2
IOI = 1
Oleh Saya Diogo Lopes Dias
Apakah Anda ingin mereferensikan teks ini di sekolah atau karya akademis? Lihat:
HARI, Diogo Lopes. "Apa itu isomerisme?"; Sekolah Brasil. Tersedia di: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Diakses pada 27 Juni 2021.