Katalis adalah zat yang mampu mempercepat reaksi tanpa diubah, yaitu, mereka tidak dikonsumsi selama reaksi.
Untuk memahami cara kerja katalis, kita perlu mengingat apa yang dijelaskan dalam teks "Energi aktivasi”. Seperti yang ditunjukkan di sana, untuk memulai reaksi kimia, perlu bahwa reaktan memiliki atau menerima sejumlah energi minimum, yang disebut energi aktivasi.
Dengan energi minimum ini, reaktan dapat mencapai kompleks diaktifkan, yang merupakan keadaan antara (keadaan transisi) yang terbentuk antara reaktan dan produk, di mana struktur ada tautan sebelumnya yang melemah dan pembentukan tautan baru (hadir di produk).
Sebagai contoh, perhatikan reaksi umum di bawah ini:
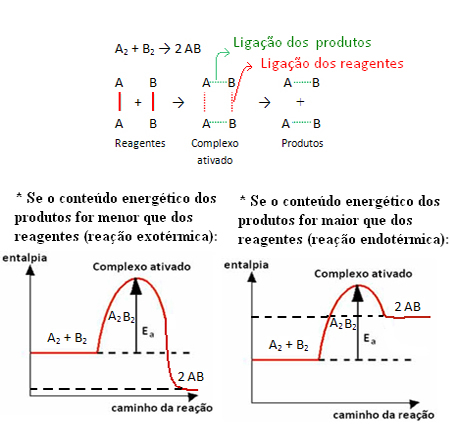
Perhatikan bahwa energi aktivasi yang dibutuhkan untuk mencapai kompleks teraktivasi menjadi semacam rintangan yang perlu diatasi agar reaksi dapat berlangsung. Artinya semakin besar energi aktivasi suatu reaksi, semakin besar hambatan yang harus diatasi dan semakin lambat kecepatan reaksi.
Hal sebaliknya juga berlaku, jika energi aktivasi lebih rendah, reaksi akan lebih cepat. Itulah tepatnya
katalis Apakah mereka mereka menciptakan jalur alternatif, yang membutuhkan lebih sedikit energi aktivasi, membuat reaksi berlangsung lebih cepat.Jangan berhenti sekarang... Ada lagi setelah iklan ;)

Untuk menurunkan energi aktivasi, katalis bertindak dengan mengubah mekanisme reaksi, dengan menggabungkan dengan reagen dalam sistem yang dapat monofasik (katalisis homogen) atau polifasik (katalisis heterogen).
Rincian lebih lanjut tentang jenis katalisis ini dapat dilihat pada teks di bawah ini:
- katalisis homogen
- katalisis heterogen
Tapi, secara umum, kita dapat mengatakan bahwa ini Kombinasi reaktan dan katalis membentuk senyawa antara yang kemudian berubah, menghasilkan produk dan katalis. Perhatikan bagaimana ini dapat direpresentasikan:
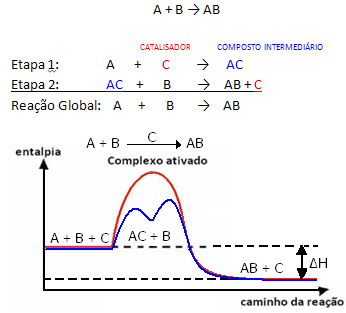
Lihat bahwa katalis diregenerasi pada akhir reaksi, tidak dikonsumsi olehnya.
Fakta penting adalah bahwa katalis mempercepat reaksi maju dan reaksi balik, itu berarti menurunkan energi aktivasi keduanya.
Oleh Jennifer Fogaa
Lulus kimia
Apakah Anda ingin mereferensikan teks ini di sekolah atau karya akademis? Lihat:
FOGAÇA, Jennifer Rocha Vargas. "Bagaimana zat katalis bekerja?"; Sekolah Brasil. Tersedia di: https://brasilescola.uol.com.br/quimica/como-atuam-as-substancias-catalisadoras.htm. Diakses pada 27 Juni 2021.

