Ahli kimia Prancis Joseph Louis Proust (1754-1826) melanjutkan untuk melakukan eksperimen yang cermat terkait massa komponen reaksi tertentu.
Misalnya, unsur-unsur yang membentuk air adalah hidrogen dan oksigen. Proust menemukan bahwa dalam reaksi pembentukan air ini, hidrogen selalu bereaksi dengan oksigen dalam perbandingan yang tetap dan pasti, yaitu 1:8. Lihat bagaimana ini terjadi di bawah ini:

Perhatikan itu tidak peduli berapa banyak massa elemen yang digunakan, proporsinya akan selalu sama.
Proust mencatat bahwa ini tidak hanya terjadi pada air, tetapi dengan semua zat lainnya.
15,06 g tembaga sulfida (CuS) terbentuk, misalnya, dengan mereaksikan 10,00 g logam tembaga (Cu) dengan 5,06 g belerang (S). Jadi, jika kita menggandakan jumlah tembaga (yang akan menjadi 20,0 g), dan jika kita ingin semua tembaga bereaksi, juga perlu menggandakan jumlah belerang, menjadi 10,12 g, dengan total pembentukan 30,12 g sulfida.
Sekarang, jika jumlah yang ditambahkan tidak proporsional, jumlah kelebihan akan tersisa, tidak akan bereaksi. Perhatikan ini di bawah ini:
Jangan berhenti sekarang... Ada lagi setelah iklan ;)
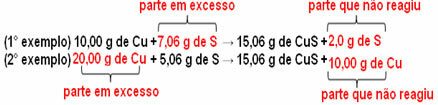
Perhatikan itu reaksi hanya berlangsung menurut proporsi yang ditentukan. Oleh karena itu, pada tahun 1799, Proust menyimpulkan bahwa, ketika beberapa zat bergabung untuk membentuk senyawa, ini selalu dilakukan dalam hubungan massa yang ditentukan.
Jadi dia menciptakan Hukum yang disebut Hukum Proust, Hukum Proporsi Konstan atau Hukum Proporsi Ditetapkan, yang dinyatakan sebagai berikut:

Hukum ini dan Hukum Lavoisier (Hukum Konservasi Massa) diberi nama Hukum Berat, karena mereka berbicara dalam massa zat yang terlibat.
Oleh Jennifer Fogaa
Lulus kimia
Apakah Anda ingin mereferensikan teks ini di sekolah atau karya akademis? Lihat:
FOGAÇA, Jennifer Rocha Vargas. "Hukum Proust atau Hukum Proporsi Konstan"; Sekolah Brasil. Tersedia di: https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm. Diakses pada 27 Juni 2021.