Lampu halogen (juga disebut lampu halogen) banyak digunakan oleh para profesional di: arsitektur dan desain interior untuk menciptakan lingkungan berbeda yang membutuhkan lebih banyak titik pencahayaan intens.
Lampu ini memiliki prinsip operasi yang sama dengan lampu pijar, yaitu umumnya dibentuk oleh ampul dengan filamen tipis tungsten (W), logam dengan titik leleh yang sangat tinggi, tahan tinggi suhu. Ketika filamen tungsten ini dilalui oleh arus listrik, ia memancarkan cahaya putih yang berwarna agak kuning.
Seiring waktu, tungsten menyublim (berubah dari padat menjadi gas) dari filamen dan mengendap di bohlam, menggelapkan bohlam:
W(s) W(g)
Namun, perbedaan antara lampu pijar biasa dan lampu halogen adalah bahwa yang terakhir mengandung yodium gas di dalamnya. Yodium berasal dari keluarga halogen dalam tabel periodik, oleh karena itu nama yang diberikan untuk jenis lampu ini.
Dalam filamen, yodium bereaksi dengan tungsten gas yang dilepaskan, membentuk gas tungsten iodida:
Jangan berhenti sekarang... Ada lagi setelah iklan ;)
W(g) + 3 aku2 (g) WI6 (g)
Ketika gas ini mendekati bola lampu, yang merupakan daerah yang lebih dingin, ia terurai, sehingga memulihkan tungsten logam (padat), yang sekali lagi disimpan pada filamen.
saya6 (g) W(s) + 3 aku2 (g)
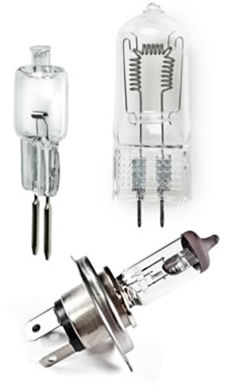
Hasilnya lampu jenis ini tidak redup dan tahan lama. Lampu pijar biasa bertahan rata-rata 1 tahun atau 1000 jam, sedangkan lampu halogen bertahan 2000 jam dan bisa mencapai 5000 jam. Mereka juga sedikit lebih efisien atau ekonomis daripada lampu pijar. Namun, perlu dicatat bahwa mereka mengkonsumsi lebih banyak energi dibandingkan dengan yang fluorescent atau discharge.
Poin-poin ini dan fakta bahwa cahayanya lebih terang daripada lampu pijar biasa membuat penggunaannya semakin meningkat.
Salah satu jenis lampu halogen adalah lampu dichroic, yang memiliki reflektor yang mengurangi panas berlebih yang dihasilkan.
Oleh Jennifer Fogaa
Lulus kimia
Apakah Anda ingin mereferensikan teks ini di sekolah atau karya akademis? Lihat:
FOGAÇA, Jennifer Rocha Vargas. "Keseimbangan kimia dalam lampu halogen"; Sekolah Brasil. Tersedia di: https://brasilescola.uol.com.br/quimica/equilibrio-quimico-lampadas-halogenas.htm. Diakses pada 28 Juni 2021.
Kimia

Uji pengetahuan Anda dan pelajari lebih lanjut dengan daftar latihan soal neraca kimia ini. Melalui materi ini, Anda akan dapat lebih memahami cara kerja konstanta kesetimbangan (Kp, Kc dan Ki), pergeseran kesetimbangan, pH dan pOH, serta kesetimbangan dalam larutan penyangga.


