Di ikatan kimia adalah interaksi yang terjadi antar atom untuk menjadi molekul atau zat dasar suatu senyawa. Ada tiga jenis tautan: kovalen, logam dan ionik. Atom mencari, dengan membuat ikatan kimia, untuk menstabilkan diri secara elektronik. Proses ini dijelaskan oleh teori oktet, yang menyatakan bahwa setiap atom, untuk mencapai stabilitas, harus memiliki delapan elektron di kulit valensinya.
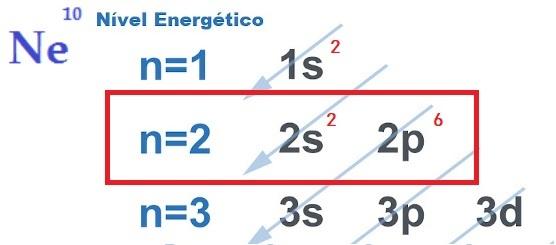
Ikatan Kimia dan Aturan Oktet
ITU mencari stabilitas elektronik, yang membenarkan realisasi ikatan kimia antara atom, dijelaskan oleh teori oktet. Diusulkan oleh Newton Lewis, teori ini menyatakan bahwa interaksi atom terjadi sehingga setiap unsur memperoleh kestabilan gas mulia, yaitu, delapan elektron dalam lapisan valensi.
Untuk ini, elemen memberi, menerima, atau berbagi elektron dari kulit terluarnya, oleh karena itu membuat ikatan kimia yang bersifat ionik, kovalen atau logam. Kamu gas mulia mereka adalah satu-satunya atom yang sudah memiliki delapan elektron di kulit terluarnya dan itulah sebabnya mereka tidak banyak bereaksi dengan unsur lain.
Lihatjuga: Aturan distribusi elektronik: bagaimana melakukannya?
Jenis ikatan kimia
Untuk mendapatkan delapan elektron di kulit valensi seperti yang diprediksi oleh aturan oktet, atom-atom berikatan bersama, yang bervariasi sesuai dengan kebutuhan untuk menyumbangkan, menerima atau berbagi elektron dan juga sifat atom ikatan.
ikatan ion
Juga dikenal sebagai ikatan elektrovalen atau heteropolar, terjadi antara logam dan unsur yang sangat elektronegatif (ametals dan hidrogen). Dalam jenis panggilan ini, logam cenderung kehilangan elektron, menjadi kation (ion positif), dan non-logam dan hidrogen mendapatkan elektron, menjadi anion (ion negatif).
Kamu senyawa ionik keras dan rapuh, memiliki titik didih dan konduktivitas yang tinggi arus listrik ketika mereka dalam keadaan cair atau diencerkan dalam air.
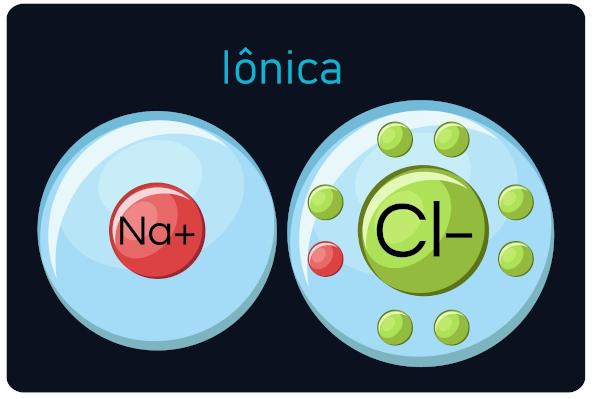
Pengamatan: Perhatikan bahwa atom yang memperoleh elektron akan menjadi ion bertanda negatif, dan atom yang kehilangan elektron menjadi bertanda positif.
Contoh zat ionik:
- Bikarbonat (HCO3-);
- Amonium (NH4+);
- Sulfat (SO4-).
Untuk mempelajari lebih lanjut tentang jenis ikatan kimia ini, kunjungi teks kami: ikatan ion.
Jangan berhenti sekarang... Ada lagi setelah iklan ;)
ikatan kovalen
Di ikatan kovalen terjadi oleh berbagi elektron. Karena perbedaan keelektronegatifan yang rendah antara unsur-unsur pengikat, mereka tidak menyumbangkan atau menerima elektron, tetapi berbagi pasangan elektronik sehingga stabil menurut aturan oktet. Jenis koneksi ini sangat umum pada elemen sederhana seperti Cl2, H2, O2, dan juga dalam rantai karbon. perbedaan dari keelektronegatifan antara ligan menentukan apakah ikatan itu polar atau non-polar.

Baca juga:Polaritas molekul: bagaimana mengidentifikasi?
ikatan kovalen datif
Disebut juga ikatan kovalen koordinat, semipolar, datif atau ikatan koordinat, sangat mirip dengan ikatan kovalen, perbedaan antara keduanya adalah bahwa salah satu atom dalam ikatan datif bertanggung jawab untuk berbagi dua elektron. Dalam jenis koneksi ini, itu terjadi secara artifisial, molekul memperoleh karakteristik yang sama sebagai molekul yang dihasilkan dari ikatan kovalen spontan.
Tautan logam
Ikatan semacam ini terjadi antara logam, yang meliputi unsur-unsur keluarga 1A (logam alkali), 2A (logam alkali tanah) dan logam transisi (blok B dari tabel periodik - golongan 3 sampai 12), membentuk apa yang kita sebut paduan logam. Karakteristik diferensial dalam kaitannya dengan jenis koneksi lainnya adalah: pergerakan elektron, yang menjelaskan fakta bahwa bahan logam, dalam keadaan padat, adalah konduktor listrik dan termal yang sangat baik. Selain itu, paduan logam memiliki titik leleh dan titik didih yang tinggi, keuletan, kelenturan, dan kilau. Contoh paduan logam adalah:
baja: besi (Fe) dan karbon C;
perunggu: tembaga (Cu) + timah (Sn);
kuningan: tembaga (Cu) + seng (Zn);
emas: emas (Au) + tembaga (Cu) atau perak (Ag).

Ringkasan
- Ikatan kimia: interaksi antara atom yang mencari stabilitas elektronik.
- Jenis panggilan: ionik, kovalen, dan logam.
- Aturan Oktet: mendefinisikan bahwa, agar atom stabil, ia harus memiliki delapan elektron di kulit valensinya.
latihan yang diselesaikan
pertanyaan 1 - (Mackenzie-SP) Untuk atom belerang dan kalium untuk memperoleh konfigurasi elektronik yang sama dengan gas mulia, perlu bahwa:
(Data: nomor atom S = 16; K = 19).
a) belerang menerima 2 elektron dan kalium menerima 7 elektron.
b) belerang memberikan 6 elektron dan kalium menerima 7 elektron.
c) belerang menghasilkan 2 elektron dan kalium menghasilkan 1 elektron.
d) belerang menerima 6 elektron dan kalium melepaskan 1 elektron.
e) belerang menerima 2 elektron dan kalium melepaskan 1 elektron.
Resolusi
Alternatif E Karena belerang berada dalam keluarga 6A atau 16, dengan mematuhi aturan oktet, belerang perlu memperoleh 2 elektron agar memiliki 8 di kulit valensinya. Kalium, di sisi lain, yang termasuk dalam keluarga pertama tabel periodik (1A atau keluarga hidrogen), untuk memiliki konfigurasi gas mulia di lapisan valensinya, ia perlu kehilangan 1 elektron. Dengan menggabungkan 2 atom kalium dengan 1 atom belerang, kita dapat membentuk ikatan ion di mana kedua elemen stabil secara elektrik.
pertanyaan 2 - (UFF) ASI merupakan makanan yang kaya akan zat organik, seperti protein, lemak dan gula, serta zat mineral seperti kalsium fosfat. Senyawa organik ini memiliki ciri utama ikatan kovalen dalam pembentukan molekulnya, sedangkan mineral juga memiliki ikatan ionik. Periksa alternatif yang menyajikan konsep ikatan kovalen dan ion dengan benar, berturut-turut:
a) Ikatan kovalen hanya terjadi pada senyawa organik.
b) Ikatan kovalen dilakukan dengan transfer elektron, dan ikatan ionik dilakukan dengan berbagi elektron dengan spin yang berlawanan.
c) Ikatan kovalen dibuat oleh tarikan muatan antara atom, dan ikatan ionik, dengan pemisahan muatan.
d) Ikatan kovalen dibuat dengan menggabungkan atom-atom dalam molekul, dan ikatan ionik, dengan menggabungkan atom-atom dalam kompleks kimia.
e) Ikatan kovalen dilakukan dengan berbagi elektron, dan ikatan ion dilakukan dengan transfer elektron.
Resolusi
Alternatif E
Mari kita lihat yang lain:
- Alternatif untuk: salah karena ikatan kovalen juga terjadi pada senyawa anorganik seperti CO2.
- Alternatif b: salah, karena ikatan kovalen terjadi dengan berbagi, dan ikatan ionik melalui transfer elektron.
- Alternatif c: Baik ikatan kovalen maupun ikatan ion terjadi melalui kebutuhan untuk kehilangan atau memperoleh elektron, bukan melalui gaya tarik elektrostatik antara inti.
- Alternatif d: Kedua ikatan, baik kovalen dan ionik, terjadi dengan menggabungkan atom dalam sebuah molekul.
pertanyaan 3 - (PUC-MG) Tinjau tabel, yang menunjukkan sifat tiga zat, X, Y dan Z, di bawah kondisi sekitar.
| Zat | Suhu leleh (c°) | konduktivitas listrik | Kelarutan dalam air |
| x | 146 | tidak ada |
larut |
| kamu | 1600 | tinggi | tidak larut |
| z | 800 | hanya meleleh atau dilarutkan dalam air | larut |
Mempertimbangkan informasi ini, adalah BENAR untuk menyatakan bahwa zat X, Y dan Z berturut-turut adalah:
a) ionik, logam, molekuler.
b) molekuler, ionik, metalik.
c) molekul, logam, ionik.
d) ionik, molekuler, logam.
Resolusi
Alternatif C.
Zat X adalah molekul, karena ikatan molekul, juga disebut kovalen, memiliki titik didih rendah, karena perbedaan elektronegativitas antara ligan tidak sangat tinggi. Umumnya senyawa kovalen tidak memiliki konduktivitas listrik, dan kelarutannya bervariasi.
Kita dapat mengenali zat Y sebagai logam, karena logam memiliki titik leleh yang tinggi, merupakan konduktor listrik yang sangat baik dan tidak larut dalam air.
Akhirnya, zat Z bersifat ionik, karena titik lelehnya relatif tinggi untuk zat ini, yang merupakan konsekuensi dari susunan kristal molekul. Ketika zat ionik dilarutkan dalam air atau dalam keadaan cair, ia memiliki ion bebas, yang membuatnya menghantarkan elektron dan larut dalam air.
Oleh Laysa Bernardes Marques
guru kimia



