logam adalah elemen yang dicirikan oleh kecerahan, kekuatan, konduktivitas termal dan listrik. Mereka berlaku di hampir semua proses industri, hadir dalam paduan logam yang digunakan dalam pembuatan alat, perhiasan dan koin dan dalam proses kimia seperti redoks, bertanggung jawab untuk pengoperasian tumpukan dan baterai.
Dalam Tabel Periodik, mereka diklasifikasikan menjadi:
semilogam
logam transisi
logam alkali
logam alkali tanah
Dalam industri baja, mereka dipisahkan menjadi:
logam besi
logam non-ferrous
logam berat
Baca juga: Apa elemen baru dari tabel periodik?
Karakteristik logam

Mereka, sebagian besar, merupakan konduktor panas dan listrik yang sangat baik.
Mereka memiliki penampilan yang mengkilap.
memiliki tinggi massa jenis.
Mereka adalah elemen elektropositif (mereka cenderung membentuk kation — muatan positif).
Dengan pengecualian Air raksa, mereka adalah elemen dengan titik leleh tinggi dan padat pada suhu kamar.
Mereka memiliki kekuatan mekanik (keuletan).
Mereka dapat ditempa (dapat dibentuk tanpa patah).
Jangan berhenti sekarang... Ada lagi setelah iklan ;)
Logam Tabel Periodik
logam alkali
Apakah elemen dari kolom pertama dari tabel periodik, keluarga 1A. Mereka disebut logam alkali karena, ketika dicampur dengan air, mereka membentuk hidroksida, yaitu larutan basa (basa).
Kamu elemen yang termasuk dalam kelompok ini adalah:
Litium (li)
Sodium (Di)
Kalium (K)
Rubidium (Rb)
Sesium (Cs)
Fransium (Fr)
Konfigurasi elektronik logam alkali dalam keadaan netral (tidak bermuatan/terionisasi) hanya menunjukkan elektron di kulit terakhir (lapisan valensi). HAI sinar atom dan reaktivitas logam ini meningkat dari atas ke bawah (mengamati Tabel periodik). Mereka memiliki titik leleh yang rendah dibandingkan dengan logam lain, mudah dibentuk dan tidak terlalu padat, memiliki aspek matte karena matte potensial oksidasi tinggi.
Lihat juga:Apa saja sifat-sifat materi?
logam alkali tanah
Ini adalah elemen yang muncul di kolom kedua dari tabel periodik, keluarga 2A. disebut alkali tanah oleh kecenderungan untuk membentuk larutan yang bersifat basa (basa), dan oleh karena, sebelum abad ke-19, oksida yang dibentuk oleh zat-zat ini ditetapkan demikian. Istilah ini digunakan untuk menunjuk logam tidak larut yang tidak mengalami mutasi ketika dipanaskan, karakteristik umum dari unsur golongan 2. Belakangan, berdasarkan penelitian dan eksperimen baru, ditemukan bahwa unsur "bumi" sebenarnya adalah oksida yang dibentuk oleh logam.
Mereka adalah logam lunak, dengan kepadatan rendah, memiliki dua elektron pada kulit terluarnya, ditemukan, dalam kondisi suhu dan tekanan normal, dalam keadaan padat. Milik grup ini:
Berilium (Menjadi)
Magnesium (Mg)
Kalsium (Sini)
Stronsium (Tuan)
Barium (Ba)
Radio (Katak)
logam transisi
membuat grup B dari Tabel Periodik, dan terletak di antara logam alkali tanah dan logam. Mereka didefinisikan oleh IUPAC sebagai elemen yang memiliki sublapisan energik energeticad yang tidak lengkap. Syarat "logam transisi" mengacu pada transisi dari grup 2 ke 13 dalam Tabel Periodik dan penambahan elektron yang meningkat di orbital 'd'.
Gugus logam transisi terdiri dari unsur-unsur padat, dengan titik leleh dan titik didih yang tinggi, dan kurang reaktif dibandingkan logam golongan 1 dan 2 (Keluarga 1A dan 2A). Di antara logam transisi adalah tungsten, yang merupakan unsur dengan titik leleh tertinggi (3422 °C), dan merkuri (Hg), yang adalah logam yang cair dalam kondisi suhu dan tekanan normal, titik lelehnya adalah (-38,83 °C).
Logam transisi memiliki berbagai keadaan oksidasi (NOX variabel) dan membentuk zat berwarna.

Elemen transisi internal
Elemen transisi internal mereka:
Lantanida: seri terdiri dari unsur-unsur yang memiliki 57-71 proton dan itu, dengan pengecualian promethium, adalah alami.
Aktinida: kelompok yang dibentuk oleh unsur-unsur mulai dari 89 hingga 103 dalam nomor atom dan yang, sebagian besar, adalah sintetis. Semua grup ini adalah radioaktif dengan waktu paruh yang pendek.
Unsur-unsur dari kedua kelompok ini memiliki titik leleh yang tinggi dan semuanya padat pada suhu kamar.
Semi logam
Kamu semilogam ada, secara keseluruhan, tujuh elemen:
Boron (B)
Silikon (Si)
Germanium (Ge)
Arsenik (As)
Antimon (Senin)
Telurium (Te)
Polonium (Po)
Klasifikasi ini diberikan kepada unsur-unsur yang memiliki karakteristik fisikokimia yang relevan dengan logam dan juga lainnya yang relevan dengan elemen non-logam. Semimetals memiliki kilau, merupakan senyawa rapuh, mampu membentuk kation dan juga anion (tergantung kondisinya), dan merupakan konduktor perantara.
Jenis Logam
besi: zat yang mengandung zat besi dalam komposisinya. Mereka paduan logam yang mengandung besi sebagai elemen umum, tetapi dapat diformulasikan dengan konsentrasi yang berbeda dari karbon, misalnya, atau ditempa dengan teknik yang berbeda, sehingga memiliki produk dengan sifat fisik yang berbeda.
Non-besi: paduan yang dibentuk oleh jenis logam lain, seperti: aluminium, tembaga, nikel, seng, titanium.
Logam berat: timbal, nikel, seng, merkuri. Mereka adalah logam reaktif, beracun dan bioakumulatif. Mereka digunakan dalam baterai, lampu, amunisi untuk artefak militer, antara lain.
Ikatan kimia logam
Logam adalah elemen elektropositif, yaitu, mereka memiliki kecenderungan untuk kehilangan elektron dalam ikatan kimia. Ketika logam berinteraksi dengan non-logam, itu melakukan ikatan ion karena perbedaan keelektronegatifan. Kemungkinan ikatan lain untuk logam adalah ikatan logam.
Di sambungan logam terjadi antara logam, dengan pelepasan sebagian elektron dan pembentukan awan atau lautan elektron di sekitar atom, yang menjamin sifat-sifat bagian logam daya konduksi listrik dan kelenturan.
Lihat juga: Konduktor dan isolator - apa perbedaannya?
Mendapatkan logam
Sebagian besar logam ditemukan secara alami di batuan dan mineral yang berasosiasi dengan unsur lain. Ada beberapa teknik untuk pemurnian logam, seperti melalui elektrolisis dan reaksi kimia untuk memisahkan senyawa.
Dalam kasus logam, dua teknik yang paling sering digunakan pada skala industri untuk mendapatkan tingkat kemurnian tertentu dalam logam adalah: perbedaan dari massa jenis dan suseptibilitas magnet (kecenderungan bahwa logam harus bereaksi terhadap a Medan gaya).

latihan yang diselesaikan
Pertanyaan 1 - (Enem) Kadmium, yang terdapat dalam baterai, dapat mencapai tanah ketika bahan-bahan ini dibuang secara tidak teratur ke lingkungan atau ketika dibakar. Berbeda dengan bentuk logam, ion Cd2+ sangat berbahaya bagi tubuh karena dapat menggantikan Ion Ca2+, menyebabkan penyakit degeneratif pada tulang, membuatnya sangat keropos dan menyebabkan nyeri hebat pada tulang. sendi. Mereka juga dapat menghambat enzim yang diaktifkan oleh kation Zn2+, yang sangat penting untuk fungsi ginjal. Gambar tersebut menunjukkan variasi jari-jari beberapa logam dan kationnya masing-masing.
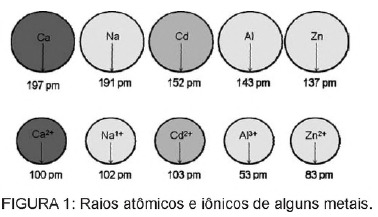
Berdasarkan teks, toksisitas kadmium dalam bentuk ioniknya adalah konsekuensi dari unsur ini
A) menghadirkan energi ionisasi rendah, yang mendukung pembentukan ion dan memfasilitasi pengikatannya dengan senyawa lain.
B) memiliki kecenderungan untuk bertindak dalam proses biologis yang dimediasi oleh kation logam dengan muatan mulai dari +1 hingga +3.
C) memiliki radius dan muatan yang relatif dekat dengan ion logam yang bekerja pada proses biologis, sehingga menyebabkan gangguan pada proses tersebut.
D) memiliki jari-jari ion yang besar, memungkinkannya untuk mengganggu proses biologis di mana ion yang lebih kecil biasanya berpartisipasi.
E) memiliki muatan +2, yang memungkinkannya mengganggu proses biologis di mana, biasanya, ion dengan muatan lebih rendah berpartisipasi.
Resolusi
Alternatif C. Kadmium adalah unsur yang mirip dengan ion logam yang secara alami kita miliki di dalam tubuh. Selain bersifat bioakumulatif, kadmium, yang memiliki kesamaan dengan gugus logam, dapat berikatan dengan gugus sulfhidril molekul. protein, sehingga menyebabkan perubahan dalam proses biologis, seperti dekalsifikasi, dan penghancuran jaringan dan sel darah merah darah.
Pertanyaan 2 - Untuk karakteristik yang relevan dengan logam, centang alternatif yang salah.
A) Sebagian besar logam adalah konduktor listrik dan termal yang baik.
B) Beberapa logam rentan terhadap oksidasi dan/atau reduksi.
C) Besi adalah logam yang tahan dan mudah dibentuk, yaitu mudah dibentuk.
D) Logam alkali tanah memiliki nama ini "tanah" mengacu pada oksida logam ini, yang berwarna gelap.
E) Logam adalah unsur yang beraneka warna dan kusam, karena adanya aksi oksidasi.
Resolusi
Alternatif E Logam secara alami mengkilap dan berwarna metalik, mereka dapat mengalami oksidasi, yang menyebabkan perubahan karakteristik yang relevan dengan relevant aspek bagian, tetapi ini bukan fenomena yang terjadi di semua logam, dan, dalam beberapa kasus, oksidasi tergantung pada beberapa faktor luar.
oleh Laysa Bernardes
guru kimia


