ITU entalpi pembentukan, disebut juga entalpi pembentukan standar, atau panas pembentukan standar, adalah perhitungan kalor yang dilepaskan atau diserap dalam pembentukan 1 mol zat dari zat sederhana, dalam keadaan standar.
Tidak mungkin menghitung nilai mutlak entalpi tiap zat, tetapi variasi entalpi yang terjadi dalam reaksi dapat dihitung dengan kalorimeter.
Perlu diingat bahwa disepakati untuk mengadopsi nilai entalpi yang sama dengan nol untuk zat sederhana dalam keadaan standar. Jadi, jika kita ingin mengetahui berapa entalpi pembentukan suatu zat, kita hanya perlu mengetahui nilai entalpi reaksi pembentukannya dari zat sederhana.
Misalnya, kita ingin mencari entalpi 18 gram air, yang sesuai dengan 1 mol, karena massa molarnya adalah 18 g/mol. Untuk melakukan ini, pertama-tama kita perlu reaksi untuk membentuk air dari zat sederhana, seperti yang ditunjukkan di bawah ini:
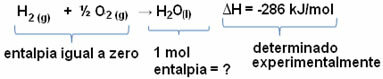
Perhatikan bahwa nilai perubahan entalpi yang terjadi dalam reaksi ini ditentukan secara eksperimental dengan kalorimeter dan sama dengan -286 kJ/mol.
Rumus yang menghitung perubahan entalpi (ΔH) ini adalah:
H = HProduk - HReagen
Jadi, karena kita sudah mengetahui nilai H dan bahwa entalpi reaktan sama dengan nol (karena mereka adalah zat sederhana dalam keadaan standar), maka kita dapat menyimpulkan bahwa nilai entalpi 1 mol air sama dengan perubahan entalpi reaksi pembentukan, karena itu adalah satu-satunya produk dari reaksi itu, seperti yang ditunjukkan di bawah:
H = HProduk - HReagen
-286 kJ/mol = HH2O - (HH2 + H1/2 HAI2)
-286 kJ/mol = HH2O - 0
HH2O = - 286 kJ/mol
Jenis entalpi ini, yang diperoleh dari entalpi zat sederhana dalam keadaan standar, oleh karena itu adalah entalpi pembentukan standar (ΔH0).
Sekarang, ada banyak zat yang tidak terbentuk secara langsung oleh reaksi tunggal, seperti air. Dalam kasus seperti itu, entalpi pembentukan dapat dihitung dari variasi entalpi reaksi.
Misalnya NH4Cl terbentuk melalui reaksi berikut:
NH3 + HCl → NH4Cl H = -176 kJ/mol
Perhatikan bahwa tidak ada reaktan yang merupakan zat sederhana, jadi kita tidak dapat menetapkan entalpi nol pada mereka. Kita perlu mengetahui entalpi pembentukan masing-masing pereaksi, karena ini dibentuk oleh reaksi antara zat sederhana:
NH3: H = -46 kJ/mol
HCl: H = -92,4 kJ/mol
Menambahkan dua entalpi ini bersama-sama, kita mendapatkan nilai entalpi reaktan dan kita dapat menemukan entalpi NH4Kl:
HR = HNH3 + HHCl
HR = (-46 + (-92,4) kJ/mol)
HR = -138,4 kJ/mol
Substitusi ke dalam rumus:
H = HProduk - HReagen
-176 = HNH4Cl - ( -138,4)
HNH4Cl = - 176 - 138,4
HNH4Cl = -314,4 kJ/mol
Dalam hal ini, kami langsung menjumlahkan nilai entalpi pembentukan reaktan karena rasio reaksi hanya 1 mol. Namun, jika dalam reaksi lain jumlah mol berbeda, pertama-tama perlu dikalikan entalpi pembentukan reaktan dengan jumlah mol.
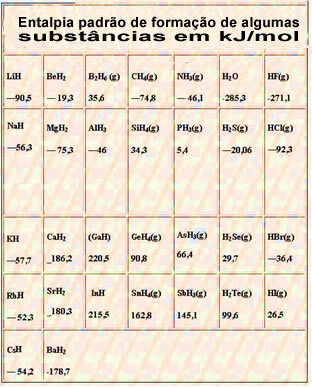
Di bawah ini adalah tabel dengan entalpi pembentukan standar beberapa zat pada 25 °C dan 1 atm:
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm
