A szövegben "Magmás elektrolízis”, Kifejtették, hogy ez a folyamat akkor következik be, amikor egy elektromos áramot olvadt anyagban (folyékony állapotban) vezetnek át, anélkül, hogy vizet, és ily módon a kation befogadja az elektronokat, az anion pedig elektront ad, így mindkettő elektromos töltése egyenlő nullával és energiával felgyülemlett.
Annak érdekében, hogy jobban megértsük, hogyan történik a magmás elektrolízis, vegyük figyelembe az ilyen típusú folyamatok egyik legfontosabb példáját, a nátrium-klorid vagy az asztali só (NaCl) elektrolízisét.
A nátrium-klorid a természetben egy elektron nátrium (Na) -ról klórra (Cl) való átvitelével képződik az alábbi reakció szerint:
2Na (s) + 1Cl2(g) → 2NaCl (s)

Ez a folyamat spontán, de ennek a reakciónak az inverz folyamata nem spontán, vagyis klórgáz (Cl2(g) - az alábbi ábra) és a fémes nátrium (Na (s)) nem fordul elő a természetben. Ha azt akarjuk, hogy ez megtörténjen, el kell indítanunk a folyamatot.
Ezt magmás elektrolízissel tehetjük meg. A sót 800,4 ° C feletti hőmérsékletre melegítik, amely az olvadáspontja; és ily módon összeolvad, szilárdból folyékonyvá válik. Ebben a fizikai állapotban a Na-ionjaid
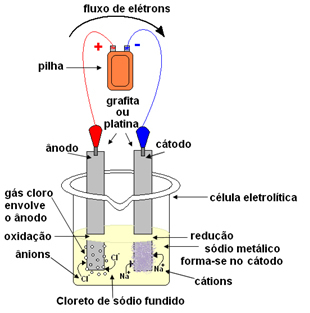
+ és Cl- szabadok.Az olvadt sót ezután egy tartályba helyezzük, az elektrolitikus edénybe, és két inert platina- vagy grafitelektródot nátrium-kloridba mártunk. Ezek az elektródák olyan áramforráshoz vannak csatlakoztatva, amely közvetlen elektromos áramot generál, például akkumulátor vagy cella.
Az elektromos áram áthaladásával a következő történik:
- Az akkumulátor vagy az elem negatív pólusa elektronokat juttat az egyik elektródához, amely katóddá válik;
- Katód: megkapja az elektronokat a cellából, és negatív pólussá válik, vonzva a Na kationokat+, mert ellentétes töltések vonzanak. Ezek az ionok az elektródot (katód) kapják meg, és redukciójuk fémes nátriumot képez:
Csökkentés:Nál nél+(ℓ) + és- → Bes
A fémes nátrium lerakódik az elektróda tetején, és egy tartályba kerül.
- Anód: pozitív töltésűvé válik, vonzza a Cl anionokat- (ezért hívják anódnak). Ezek az ionok elveszítik elektronjaikat, amikor érintkezésbe kerülnek az anóddal, és ezért oxidálódnak, klóratomokat képezve, amelyek azonnal kettőből kettőre egyesülve klórgázt képeznek:
Oxidáció:2Cl-(ℓ) → 2 és- + 1Cl2g)
Ez a gáz az anód körül forog, és a rendszerhez igazított üvegcsővel gyűlik össze.
Így az ebben az esetben bekövetkező teljes reakciót a
Katód: 2Na+(ℓ) + 2e- → 2Nas
Anód: 2Cl-(ℓ) → 2 és- + 1Cl2g) ____________
Globális reakció: 2Na+(ℓ) + 2Cl-(ℓ) → 2Nas + 1Cl2g)
Egy másik fontos szempont, amelyet figyelembe kell venni és amelyet az említett szöveg (magmás elektrolízis) végén kiemeltünk, az az, hogy az elektrolízishez bekövetkezik, az elektromos áram előállításához használt cella vagy elem ddp-jével (potenciálkülönbségével) egyenlőnek vagy nagyobbnak kell lennie, mint a reakció.
Vizsgáljuk meg ezt az általunk figyelembe vett nátrium-klorid-elektrolízis esetében. A reakció potenciális különbségének kiderítéséhez elegendő a katód standard redukciós potenciálját az anód által csökkenteni. Ezt a szöveg magyarázza. Az akkumulátor potenciális különbsége .
A standard redukciós potenciálok táblázata (E0piros), tudjuk, hogy:
Nál nél+(ℓ) + és- → Bes ÉS0piros = -2,71
2Cl-(ℓ) → 2 és- + 1Cl2g) ÉS0piros = +1,36
Csak csökkentse ezeket az értékeket, hogy megismerje a globális reakció lehetséges különbségeit:
És0 = ÉS0piros (katód) - ÉS0piros (anód)
És0 = -2,71 – (+ 1,36)
És0 = - 4,07 V
Ezért ez azt jelenti, hogy a használni kívánt cellának vagy elemnek legalább 4,07 V feszültséggel kell rendelkeznie a nátrium-klorid magmás elektrolízisének elvégzéséhez.
A negatív érték csak azt jelzi, hogy nem spontán folyamatról van szó.. Az elemek esetében, amely spontán folyamat, az elektromotoros erőérték (∆E0) mindig pozitívat ad.
Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/eletrolise-Ignea-cloreto-sodio.htm
