Mert osztályozzon szigma linket, elengedhetetlen tudni, hogyan lehet felismerni egy molekula szerkezetében. A szigma kötés valójában egy kovalens kötés, amely akkor fordul elő, amikor két nem teljes atompálya (csak egy elektronnal) behatolnak ugyanazon a tengelyen. Példa erre, amikor egy p-típusú (spirál) pálya behatol egy másik p-pályára.

p-p sigma kötésben áthatoló p pályák
Gyakorlatban (gyakorlatokon), a szigma kapcsolat felismerése és osztályozása a szerkezeti képlet alapján történik egy anyag, az alábbi szerkezeti ábrázolás szerint:

A hidrociánsav szerkezeti képlete
A sigma link osztályozása előtt tudni kell, hogyan lehet felismerni egy szerkezeti képletben. Ehhez csak emlékezzen a olyan módszerek, mint a kovalens kötés képviselteti magát: A hívás egyszerű egyetlen kötőjel (-), a pár kettővel (=) és a linkkel van ábrázolva hármas három (≡). A szigma kötés a kovalens kötések három ábrázolásának bármelyikében jelen van:
Egyszerű: szigma kötéssel rendelkezik;
Pár: A két link közül csak az egyik szigma;
Hármas: A három link egyike a szigma.
A következő lépés annak megismerése, hogyan kell felismerni a szigma linket, hogyan kell rangsorolni. Ehhez tudnunk kell, mi a kötésben részt vevő egyes atomok hiányos pályája:
H - a hiányos s pályát mutatja be, így az osztályozásban s jelképezi.
Ametálok- hiányos p pályájuk van, így a besorolásban őket p jelöli, a következő elemek kivételével:
Szén: A hiányos pályája a típustól függ hibridizáció hogy szenved. A lehetőségek a következők: sp hibridizáció3 (mennyit tesz négy egyszerű hívásból), sp2 (mennyibe kerül két egyszeres és egy kettős kötés) vagy sp (mennyit hajt végre két kettős kötést vagy egy egyszeres és egy hármasat). Így a szigma kötés besorolásakor a Carbon sp3, sp2 vagy sp a hívás függvényében.
Berillium:szenvedni sp típusú hibridizáció, így a besorolásban sp.
Bór:szenvedni sp típusú hibridizáció2, így a besorolásban sp.2.
Mindezen információk birtokában a legegyszerűbb osztályozni a struktúrában jelen lévő szigma linkeket. Lássunk néhány példát:
1. példa: szigma kapcsolatok a vízben

A víz szerkezeti képlete
A fenti szerkezeti képlet azt mutatja, hogy a víz rendelkezik két szigma kötés (kettő egyszerű), lévén ők az oxigén között (o képviseli) ez a Hidrogén (s képviseli). Így két szigma linkünk van:
s-p
2. példa: A Sigma kötődik a foszfor-trikloridban

A foszfor-triklorid szerkezeti képlete
A fenti szerkezeti képlet azt mutatja, hogy a foszfor-triklorid rendelkezik három hívásszigma (három egyszerű), lévén ők adja meg a foszfort (o képviseli) ez a klór (o képviseli). Így három szigma linkünk van:
p-p
3. példa: szigma kötések a bór-trifluoridban
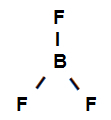
A bór-trifluorid szerkezeti képlete
A fenti szerkezeti képlet azt mutatja, hogy a bór-trifluorid rendelkezik három szigma link (három egyszerű), lévén ők adja meg a bórt (képviseli sp2) ez a Fluor (o képviseli). Így három szigma linkünk van:
p-sp2
4. példa: szigma kötések etanolban
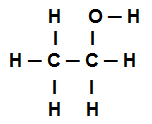
Etanol szerkezeti képlet
Az etanol fenti szerkezeti képlete azt mutatja nyolc hívás van jelen szigmák (nyolc egyszerű link). Vannak:
Az egyik az Oxigén között (képviseli p) és a hidrogén (s képviseli). Így a kapcsolat sigma s-p-be van besorolva.
Két szén egyike amelyek csak szigma kapcsolatokat hajtanak végre (és akkor képviseli sp3). Így a link a következő kategóriába tartozik sp3-P3.
Az egyik a szén között (képviseli sp3) és az oxigén (o képviseli). Így a szigma linket a következőkre osztják p-sp3.
öt szén között (képviseli sp3) és a hidrogén (s képviseli). Így mind az öt osztályba sorolható s-sp3.
5. példa: A Sigma kötődik diklór-eténben

Diklór-etén szerkezeti képlet
A fenti diklór-etén szerkezeti képlete azt mutatja, hogy jelen van öt szigma link (a négy egyes kötés és az egyik kettős kötés). Vannak:
Két szén egyike amelyek két egyszeres és egy kettős kötést hajtanak végre (majd képviseli sp2). Így a szigma linket a következőkre osztják sp2-P2.
Négy szénatom között van(képviseli sp2)és a hidrogén (s képviseli). Így mind a négy osztályba sorolható s-sp2.
Általam. Diogo Lopes Dias
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/classificacao-uma-ligacao-sigma.htm
