A eredete Periódusos táblázat század elején, 1829 körül történt, amikor a kémikusok abban az időben úgy döntöttek, hogy javaslatot tesznek a kémiai elemek addig ismert.
A 19. század elején a vegyészek több jellemzőről (sűrűségharminc kémiai elem atomtömege, reakcióképessége, olvadáspontja, forráspontja, fizikai állapota). Ez a tudás kiindulópontként szolgált a számára a periódusos rendszer eredete.
Több mint 200 év alatt több vegyész igyekezett javaslatot tenni a kémiai elemek, vagyis az A mai periódusos rendszer valójában különböző eredetű volt, mint a történelem folyamán sok kísérlet teljesített.
Elmetérkép: A periódusos rendszer eredete
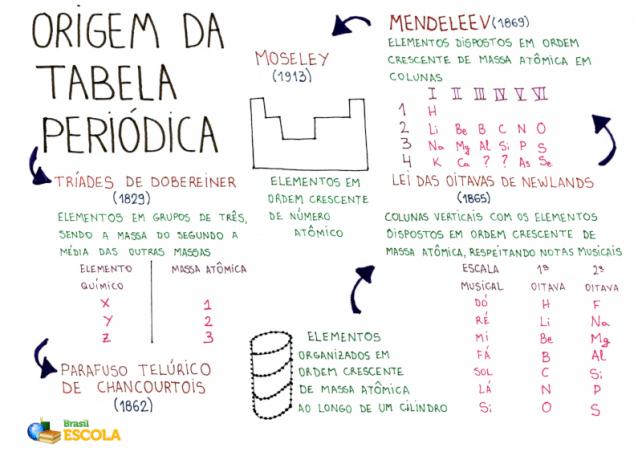
* A gondolattérkép letöltéséhez Kattints ide!
Íme néhány kémikus, akik kiválóan próbálkoztak az elemek táblázatba rendezésével.
Dobereiner-triádok

Illusztráció: Johann Wolfgang Dobereiner *
1829-ben Johann Wolfgang Dobereiner német vegyész megszervezte a történelem első periódusos rendszerét. Megvolt az addig ismert harminc kémiai elem, és ő nevezte el Dobereiner-triászoknak.
A Dobereiner periódusos rendszer triádnak hívták, mert az elemeket 3 fős csoportokba rendezték. Minden csoportnak voltak elemei, amelyek hasonló kémiai tulajdonságokkal bírtak.
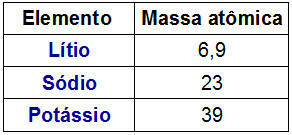
Dobereiner-triász ábrázolása
Érdekes tény a Dobereiner-triádokkal kapcsolatban, hogy a atomtömeg a triád központi elemének pontja a triád másik két elemének atomtömegei közötti számtani átlag eredménye.

Alexandre de Chancourtois tellúrcsavarja
1862-ben a francia geológus és ásványtan Alexandre de Chancourtois úgy döntött, hogy javaslatot tesz az akkor ismert kémiai elemek szervezésére az ásványtanban való alkalmazásuk megkönnyítése érdekében. A Chancourtois asztal tellurikus csavarnak hívták.

A Chancourtois tellur csavar ábrázolása
A Chancourtois a kémiai elemeket (a kép sötét foltjai) az atomtömeg növekvő sorrendjében osztotta el egy hengeres spirálsáv mentén. Ezzel a szervezéssel Chancourtois megfigyelte, hogy az ugyanazon a függőleges vonalon elhelyezkedő elemek hasonló kémiai tulajdonságokkal rendelkeznek.
Oktávok törvénye
Az oktávok törvénye volt az a név, amelyet az angol vegyész, J.A.R. Newlands, 1865-ben a periódusos rendszerbe. Mivel Newlands szintén zenész, az asztalt a hangjegyek szerint állította be (do, there, re, mi, fa, sol, there, si).
Newlands az akkor ismert 61 kémiai elemet az atomtömeg növekvő sorrendjében rendezte és függőleges oszlopokba helyezte. A függőleges oszlopok mindegyikének hét eleme volt.
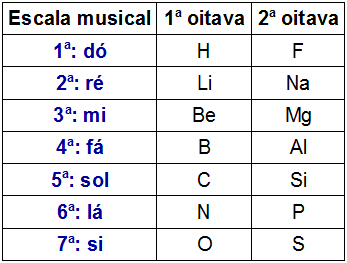
Newlands két oktáv ábrázolása
Newlands megfigyelte, hogy a különböző oktávok azonos vízszintes vonalában található kémiai elemek hasonló kémiai tulajdonságokkal rendelkeznek. Így az oktáv első eleme hasonló tulajdonságokkal rendelkezett, mint a másik oktáv első eleme stb.
Mendelejev periódusos táblázata

Mendelejev vegyész ** illusztrációja
Mendelejev, a kémiai elemekkel végzett munkája során szokása volt kártyákra felírni mindegyik tulajdonságát. Valamikor, 1869-ben, úgy döntött, hogy ezeket a jelzéseket az atomtömeg növekvő sorrendjébe helyezi.
Miután az elemeket az atomtömeg növekvő sorrendjébe rendezte, Mendelejev megtartotta a mintát, de - az elemeket vízszintes és függőleges oszlopokban helyezte el, tiszteletben tartva a elemek.
Moseley periódusos rendszer
1913-ban az angol vegyész HenrikMoseley, a Mendelejev által javasolt táblázat alapján összeállította a periódusos rendszert a ma ismert minták szerint.
Mendeelejevtől eltérően Moseley az elemeket növekvő sorrendbe rendezte atomszám, a szervezetet vízszintes és függőleges oszlopokban tartotta, de az azonos kémiai jellemzőkkel rendelkező elemeket ugyanabba a függőleges oszlopba helyezte.
az aktuális periódusos rendszer
1913 után a Moseley által javasolt periódusos rendszer nem történt jelentős változáson, sőt, néhány frissítésen esett át, mivel néhány kémiai elemet felfedeztek.
Összehasonlítva a jelenlegi táblázattal, a Moseley-táblázat nem mutatta meg például a 110 és 118 közötti atomszámú kémiai elemeket. Ezenkívül az aktinid-sorozat a lantanid-sorozat felett helyezkedett el.
A Utolsó frissítés A periódusos rendszer 2016-ban hajtotta végre, amikor a 113., 115., 117. és 118. elem hivatalosan is ennek része lett.
* Kép jóváírása: Yangchao/ redőny. Inc
** Kép jóváírása: Olga Popova/ redőny. Inc
Általam. Diogo Lopes Dias
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/origem-tabela-periodica.htm
