A termológia tanulmányában nevezzük adiabatikus transzformációk azok a gáznemű átalakulások, ahol nincs hőcsere a külső környezettel. Ezért az adiabatikus transzformáció során a hő nulla.
Q = 0
Ha a termodinamika első törvényét alkalmazzuk, akkor:
Q = ∆U + τ
∆U = - τ
De mit jelent, hogy a külső környezet között nincs hőcsere? Ez azt jelenti, hogy ha gáz halmazállapotú expanzió történik, és a gáz 300 J munkát végez, akkor nem ha a közeggel hőcsere folyik, a gáz belső energiájának változása negatív lesz, ezért nekünk lesz:
∆U = - 300 J
Most, ha csökken a gáz belső energiája, akkor azt mondhatjuk, hogy a gáz hőmérséklete is csökkent. A gázok általános törvényéből

mondhatjuk, hogy ha a térfogat növekszik és a gáz hőmérséklete csökken, szükségszerűen a gáz nyomása is csökken. Általánosságban elmondhatjuk, hogy ugyanez történik a kompresszióval is, mert ha kompresszió van, akkor a gáz belső energiája megnő, tehát a nyomás is növekszik.
Elmetérkép: Adiabatikus átalakulás
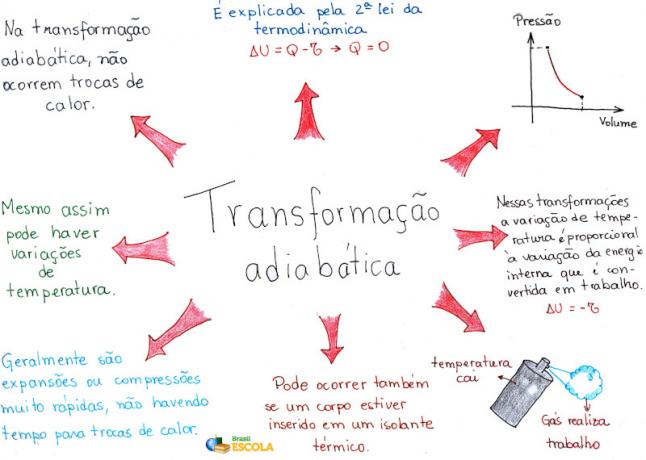
* A gondolattérkép PDF formátumban történő letöltéséhez Kattints ide!
Röviden elmondhatjuk, hogy:
- az adiabatikus expanzióban a hőmérséklet és a nyomás csökkenése;
- adiabatikus kompresszióban a hőmérséklet és a nyomás egyaránt nő.
Az alábbi ábra áttekintést nyújt az adiabatikus transzformációról:
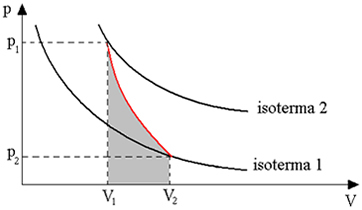
Az adiabatikus transzformációkat hőszigetelt tartályok alkalmazásával, vagy préseléssel vagy nagyon gyors expanzióval érhetjük el.
Így arra a következtetésre juthatunk, hogy amikor egy gáz hőcserét folytat a külső környezettel, időbe telik, mire a hő tovább halad a gáznemű tömegen keresztül, és egyensúlyba kerül. Ezért, ha mind a tágulást, mind a gyors összenyomást végrehajtják, gyakorlatilag nincs hőcsere a külső közeggel.
* Elmetérkép, Rafael Helerbrock
Írta: Domitiano Marques
Fizikából végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/fisica/estudo-transformacao-adiabatica.htm

