A kémiai reakció bekövetkezéséhez négy alapvető feltételnek kell megfelelni:
1. A reagenseknek kapcsolatba kell lépniük;
2. A reagensek között kémiai affinitásnak kell lennie;
3. A reagensrészecskék ütközésének hatékonynak kell lennie;
4. Az aktiválási energiát el kell érni.
Röviden lásd az egyes eseteket:
1.A reagensek közötti érintkezés:
Ez a körülmény nyilvánvaló, mert még akkor is, ha a reagensek nagy affinitással rendelkeznek egymás iránt, mint például a savak és bázisok esetében, ha elválasztják őket, a reakció nem következik be. Össze kell kerülniük, hogy részecskéik összeütközhessenek, megszakítva a reagensek kötéseit és kialakítva a termékek kötéseit.

2.Kémiai affinitás:
Mint láttuk, a reagensek érintkezésbe hozása szükséges, de nem elegendő. Például, ha a nátriumot vízzel érintkeztetjük, rendkívül heves reakció lép fel, de ha aranyat teszünk, akkor nem látunk különbséget. Ennek oka, hogy a különböző anyagok eltérő kémiai affinitással rendelkeznek egymással, vagy egyáltalán nincs affinitásuk. Minél nagyobb a kémiai affinitás, annál gyorsabb a reakció.
Az említett példákban a nátrium nagy affinitással rendelkezik a vízzel, olyannyira, hogy annak érdekében, hogy ne érintkezzen a levegő nedvességével, a fém-nátriumot petróleumban tárolják. Az arany inert, ezért tartanak olyan sokáig az arany emlékművek, mint Egyiptom szarkofágjai.

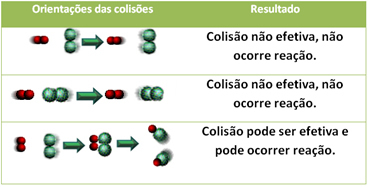
3.Ütközéselmélet:
Még olyan vegyületekben is, amelyek kémiai affinitással rendelkeznek, a reakció lejátszódásához elengedhetetlen, hogy részecskéik, atomjaik vagy molekuláik hatékonyan ütközzenek. Nem minden ütköző részecske teszi ezt hatékonyan, de sokkok, amelyek a törést eredményezik a reagenskötések és az új kötések kialakulása azok, amelyek a helyes irányban és az energiával fordulnak elő elég.
Ne álljon meg most... A reklám után még több van;)
Az alábbiakban két hatástalan ütközés és egy hatékony ütközés látható, amely a reakciót eredményezi.
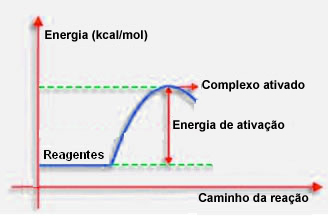
4.Aktiválási energia és aktivált komplex:
Amint az előző pontban kifejtésre került, a hatékony ütközésnek a kedvező irányítás mellett elegendő energiára is szüksége van. Az egyes reakciók végrehajtásához szükséges minimális energiamennyiséget aktivációs energiának nevezzük.
Ha a reagensek energiája egyenlő vagy nagyobb, mint az aktivációs energia, a jól orientált sokk során egy kezdetben aktivált komplex képződik, amely köztes szerkezet a reagensek és a Termékek. Az aktivált komplexben gyengült reagenskötések és új termékkötések keletkeznek.
Így az aktivációs energia egyfajta gátként működik a reakció bekövetkezésében, mert minél nagyobb, annál nehezebb lesz a reakció bekövetkezése. Bizonyos esetekben energiát kell biztosítani a reagensekhez. Például a főzőgáznak affinitása van a levegőben lévő oxigénnel való kölcsönhatásra, de energiát kell szolgáltatnunk, amikor összehozzuk a mérkőzést, különben a reakció nem megy végbe. De miután elindult, maga a reakció elegendő energiát szabadít fel a többi molekula aktiválására és a reakció folyamatos fenntartására.
Írta: Jennifer Fogaça
Kémia szakon végzett
Hivatkozni szeretne erre a szövegre egy iskolai vagy tudományos munkában? Néz:
FOGAÇA, Jennifer Rocha Vargas. "A kémiai reakciók előfordulásának feltételei"; Brazil iskola. Elérhető: https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm. Hozzáférés: 2021. június 27.


