Izobáros átalakulás akkor következik be, amikor a gáz állandó nyomáson van. Például, ha nyitott környezetben végzik, az átalakulás izobárikus lesz, mivel a nyomás olyan légköri nyomás lesz, amely nem változik.
Ebben az esetben a hőmérséklet és a térfogat változó. Két vezető tudós tanulmányozta, hogy az izobár transzformációk ez a variáció hogyan fordul elő. Először Jacques Charles (1746-1823) viszonyította a gázok mennyiségét és hőmérsékletét 1787-ben, majd 1802-ben Joseph Gay-Lussac (1778-1850) számszerűsítette ezt a kapcsolatot.
Így megjelent egy törvény, amely megmagyarázza a gázok izobár átalakulásait, amely Charles / Gay-Lussac törvény néven vált ismertté. A következőképpen fogalmaz:
"Állandó nyomású rendszerben a gáz rögzített tömegének térfogata egyenesen arányos a hőmérséklettel."

Ez azt jelenti, hogy ha megduplázzuk a hőmérsékletet, akkor a gáz által elfoglalt térfogat is megduplázódik. Másrészt, ha csökkentjük a hőmérsékletet, akkor a gázmennyiség is ugyanolyan arányban csökken.
Ez egy nagyon egyszerű kísérletben látható. Ha egy ballont helyezünk egy palack nyakába, akkor egy rögzített levegőtömeg csapdába esik. Ha ezt az üveget egy tál jeges vízbe mártjuk, a léggömb leereszt. Ha most egy tál forró vízbe tesszük, a lufi megtelik.
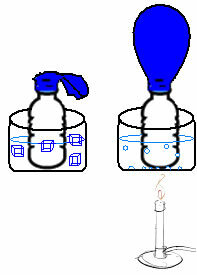
A hőmérséklet növekedésével ugyanis növekszik a gázmolekulák mozgási energiája és növekszik a mozgás sebessége is. Így a gáz kitágul, növelve az elfoglalt térfogatot, és a ballon felfújódik. Az ellenkezője akkor fordul elő, amikor alacsonyabb hőmérsékletre engedjük, hideg vízbe tesszük.
Ezt a kapcsolatot a hőmérséklet és a térfogat között az izobáros átalakulásokban a következő összefüggés adja:
V = k
T
A "k" állandó, amint az a következő grafikonon látható:
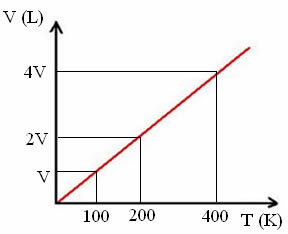
Vegye figyelembe, hogy a V / T arány mindig állandó értéket ad:
_V_ =_2V_ = _4V_
100 200 400
Így a következő kapcsolatot hozhatjuk létre az izobár transzformációkhoz:
Va kezdeti = VVégső
Ta kezdeti TVégső
Ez azt jelenti, hogy amikor állandó nyomáson bármilyen változás történik a gáz hőmérsékletén, akkor ennek a matematikai kifejezésnek a segítségével megtalálhatjuk annak térfogatát. Ennek az ellenkezője is igaz, a gáz térfogatának ismeretében megtudjuk, milyen hőmérsékleten van. Lásd egy példát:
"A gáznemű tömeg 800 cm-es térfogatot foglal el3 -23 ° C-on, adott nyomáson. Mekkora a hőmérséklet, amikor a gáznem ugyanazon a nyomáson 1,6 liter térfogatot foglal el? "
Felbontás:
Adat:
Va kezdeti = 800 cm3
Ta kezdeti = -23 ºC, a 273-hoz hozzáadva 250 K (Kelvin)
VVégső = 1,6 liter
TVégső = ?
* Először ugyanarra az egységre kell hagynunk a kötetet. Ismert, hogy 1 dm3 1 liter. mint egy 1 dm3 1000 cm-rel megegyezik3, úgy tűnik, hogy 1 liter = 1 000 cm3:
1 L 1000 cm3
x 800 cm3
x = 0,8 L
* Most kicseréljük a képletértékeket, és megtaláljuk a végső hőmérsékleti értéket:
Va kezdeti = VVégső
Ta kezdeti TVégső
0,8_ = 1,6
250 TVégső
0,8 TVégső = 250. 1,6
TVégső = 400
0,8
TVégső = 500K
* A Celsius-skálára lépve:
T (K) = T (° C) + 273
500 = T (° C) + 273
T (° C) = 500 - 273
T (° C) = 227 ° C
Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/transformacao-isobarica.htm
