Gilbert N. amerikai vegyész Lewis (1875-1946) javasolta az oktett szabályt, amely így szól:
"A különböző elemek atomjai kémiai kötéseket hoznak létre, adományozva, fogadva vagy megosztva az elektronokat annak érdekében, hogy megszerezzék a nemesgáz, vagyis 8 elektron van az utolsó héjban (vagy 2 elektronnal azon atomok esetében, amelyeknek csak egy elektronhéja van, mint a hidrogén)."
1916-ban Lewis azt javasolta, hogy stabil maradjon, elérve az oktettet vagy a duettet, az elemeket, amelyek alkotják molekuláris anyagok végezze el az elektronpárok megosztását. Ezeket az anyagokat csak a hidrogén, nemfémek és félfémek, mindezt a elektronok befogadására való hajlam. Ezért egyiküknek sincs módja bármilyen elektront adományozni (mint az ionkötésben lévő fémeknél előfordul), de mindenkinek meg kell kapnia, ezért kovalens kötés útján osztják meg elektronjaikat, ill molekuláris.
Így Gilbert Lewis javaslatot tett a kovalens vagy molekuláris kötés képviseletére, amely néven ismertté vált Lewis-formula
. Őt is hívják elektronikus képlet vagy mégis, Lewis elektronikus képlete, mert fő jellemzője, hogy mutatja az egyes atomok vegyértékű héjában lévő elektronokat és az elektronikus párok kialakulását.Minden elektront egy pont képvisel., amely körülveszi a megfelelő kémiai elem szimbólumát. Az elem körül csak a vegyértékű héj elektronok vannak.
Amint az alábbi táblázat mutatja, a vegyértékes héjban lévő elektronok mennyiségének ismeréséhez csak ismerje meg a Periódusos rendszer családját:

A Lewis-képletben minden megosztott elektronpár kémiai (kovalens) kötést képvisel, ahol az elektronok az elektroszféra azon régiójában találkoznak, amely közös az egyes összekapcsolt atompároknál. Ezért az ábrázolásban egymás mellett helyezkednek el.
Például derítsük ki, mi a Lewis-képlet a hidrogéngázra, amelynek molekulaképlete: H2.
Minden hidrogénatomnak csak egy elektronja van a vegyértékhéjban, mivel ez az elem a periódusos rendszer 1. családjába tartozik. Mindegyiknek még egy elektront kell kapnia, stabilnak kell lennie, a K elektronhéjban két elektron van. Tehát megosztják egymással az elektronjaikat, és mindkettő kettőt kap. Néz:
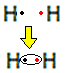
Ez a hidrogéngáz-molekula Lewis-képlete.
Az oxigénnek hat elektronja van az elektronhéjában, ezért mindegyiknek további két elektronra van szüksége ahhoz, hogy stabilak legyenek, nyolc elektronnal. Ezért az oxigéngáz-molekula Lewis-képlete:

Lásd, hogy két link van, mivel két megosztott pár van.
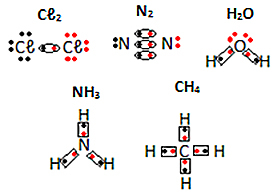
Az alábbiakban lásd a molekuláris anyagok elektronikus képleteinek egyéb példáit:
Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm
