diffúzió és effúzió századi Thomas Graham skót vegyész által a XIX gázkeverékek és viselkedése gázok amikor átmegy egy konténer falán.
Thomas Graham megfigyelései közül a gázok diffúzióval és effúzióval kapcsolatos viselkedésére vonatkozóan a következőket emelhetjük ki:
A gáz mindig hajlamos áthaladni a szilárdtest-anyagban lévő kis lyukakon;
Minél nagyobb a molekulatömeg gáz, annál nagyobb a nehézsége a szilárd anyag lyukain való áthaladásnak;
Minél kisebb a gáz sűrűsége, annál nagyobb a mozgási sebessége;
Minél magasabb hőmérsékletnek van kitéve egy gáz, annál nagyobb sebességgel terjed a környezetbe vagy átmegy egy nyíláson;
- A gáz soha nem marad statikus egy adott helyen.
Diffúzió
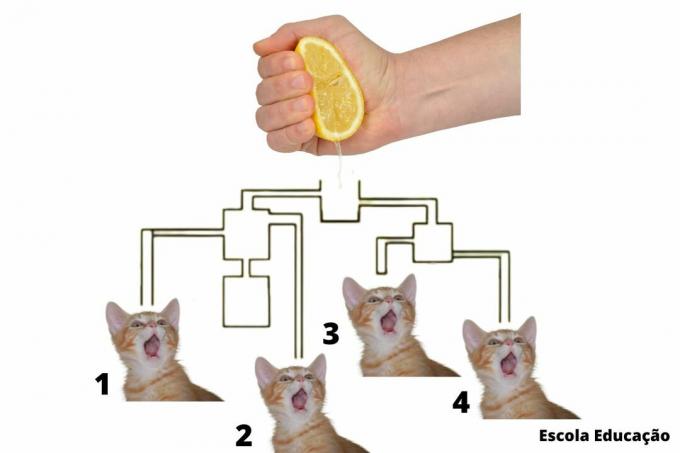
Diffúzió ez egy fizikai jelenség, amely abban áll, hogy a gáz képes diffundálni (vagyis elterjedni) az egész terület térében vagy a tartály belsejében. Emiatt azt mondhatjuk, hogy egy térben a gáz soha nem korlátozódik egyetlen helyre.

A sugárzás előfordulásának ábrázolása
Ezen felül meghatározhatjuk a diffúzió még mindig az a kapacitás, amelyet az egyik gáznak el kell kevernie a másikkal, ha ugyanabba a tartályba helyezik, és homogén gázkeveréket képez.
Példa erre, amikor a jármű kipufogógázaiból gázok kerülnek ki. Bármennyire is mérgezőek, rövid távú károsodást nem okoznak az emberekben, mivel az egész légköri levegőben elterjednek, következésképpen csökkentik koncentrációjukat.
Effúzió
Effúzió ez egy fizikai jelenség, amely abból áll, hogy a gáz egy bizonyos tartály falában lévő lyukakon keresztül halad át, vagyis abban áll, hogy a gáz az egyik környezetből a másikba távozik.

A kiömlés előfordulásának ábrázolása
Példa erre, amikor a léggömböket egy partihoz felfújják, és másnap mindet leeresztik, mindezt a léggömbökben lévő lyukakon keresztül kiszivárgó levegő miatt.
A diffúzióval és az effúzióval kapcsolatos számítások
Kiszámíthatjuk a Graham által javasolt egyenletek alapján a gáz teljesítményét diffúzió vagy effúzió. Graham szerint a tartályban összekevert két gáz diffúziós és effúziós sebessége igen mindig fordítottan arányos a relatív sűrűségük vagy moláris tömegük négyzetével.
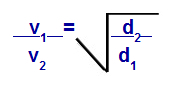
Graham törvénye a sűrűségről
v1 = az 1. gáz sebessége (effúzió vagy diffúzió) a keverékben;
v2 = a keverékben lévő gáz 2 sebessége (effúzió vagy diffúzió);
d1 = az elegy 1 gázsűrűsége;
d2 = a keverék 2. gáz sűrűsége;
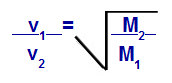
Graham törvénye a moláris miséről
v1 = az 1. gáz sebessége (effúzió vagy diffúzió) a keverékben;
v2 = a keverékben lévő gáz 2 sebessége (effúzió vagy diffúzió);
M1 = a keverék 1 mol moláris tömege;
M2 = a gáz 2 moláris tömege a keverékben.
Általam. Diogo Lopes Dias
Forrás: Brazil iskola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm