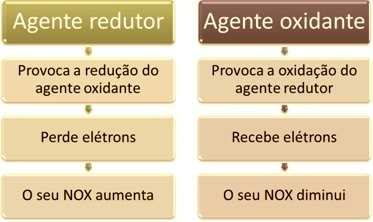
Az egyik fő jellemző, amely megkülönbözteti az oxidációs redukciós reakciót (vagy redox) a többi oxidálószer és redukálószer jelenléte, amely a következőképpen határozható meg:
Nézze meg például az alábbi kémiai reakciót, ahol az alumínium (Al) korrodál vizes sósav (HCl) oldatban. Az alumínium atomok elektronokat visznek át a H kationokba+(itt) és előállítja az Al-kationt3+(itt):
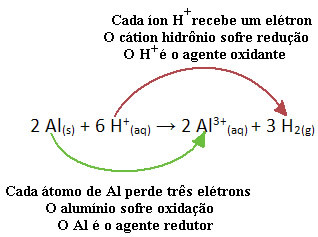
Vegye figyelembe, hogy mivel Al elektronokat szállított, ez azt jelenti ő okozta a csökkentést a H kationok közül+(itt); ezért hívják redukálószer. Már a H kation+(itt) eltávolította az elektronokat az alumíniumból, oxidációt okozva ebből a fémből; ezért a oxidálószer.
A mindennapi életben számos példa található az oxidáló és redukáló szerek teljesítményére. Nézzen meg közülük, és ne feledje, hogy a redukció minden esetben az oxidációval egyidejűleg történik; ezért ha van redukálószer, akkor van oxidálószer is.
- Példák redukálószerekre:
- Fényképészeti filmekben: a fényképészeti filmek fényérzékeny ezüst sókat tartalmaznak. Azokban a pontokban, ahol fény esik, csökken az Ag-ionok mennyisége +, ami a negatívumokban megfigyelhető kontrasztot eredményezi.

- C vitamin: A C-vitamin (L-aszkorbinsav) erős redukálószer vizes oldatban. Kivételes oxidálhatósága van, ezért széles körben használják, különösen olyan élelmiszerekben, mint a antioxidáns, vagyis más élelmiszerekhez adják, és megvédi őket az esetleges oxidációtól, a sajátja miatt áldozat. Ilyen például a gyümölcs, például az alma és a körte, amelyek a levegőben lévő oxigénnel érintkezve elsötétednek, mert oxidálódnak. De amikor kis mennyiségű narancs- vagy citromlevet (amely C-vitamint tartalmaz) ad a gyümölcshöz vágva, ez megakadályozza ennek a reakciónak a bekövetkezését, mert a C-vitamin redukálószerként működik és a gyümölcs előtt oxidálódik.

- Hidrogéngáz: a hidrogéngáz (H2) rakéta-meghajtásban használják, és az egyik legfontosabb energia-alternatívának tekintik, mivel égése során nagy mennyiségű energia szabadul fel, és nem tartalmaz szennyező anyagot. Ebben a reakcióban a hidrogén redukálószerként működik, oxigénnel oxidálva.
- Példák oxidálószerekre:
- Az ecet előállítása során: amikor a bor levegőnek van kitéve, ecetté alakul, amelynek fő alkotóeleme az ecetsav. Ennek oka, hogy a borban lévő etil-alkohol vagy etanol a légköri oxigénnel érintkezve oxidálódik, ecetsavat eredményezve. Így az oxigén oxidálószer. Még az „oxidáció” kifejezés eredete is összefügg az oxigénnel történő reakcióval.

- A rozsdában: az előző példában leírtak szerint az oxigén az alkohol oxidálószereként működik; és ezt különféle fémekkel, például vassal érintkezve is rozsdásodást idézi elő. A levegőben lévő oxigén mellett egyéb oxidálószerek ebben az esetben a víz vagy savas oldat.
- Fehérítőkben: a fehérítők fehérítő hatása a következő két redukálószer jelenlétének köszönhető: o hipoklorit-anion (általában nátriumsó - NaOCl formájában), például fehérítőben; és hidrogén-peroxid (H2O2), hidrogén-peroxidként forgalmazzák. Ez a két vegyület nagyon erősen hajlamos oxidálni és más kémiai fajok redukcióját okozni. Ezért felelősek a termékek sötét színét kölcsönző anyagok oxidálásáért. Például a cellulózban a lignin lebomlik, könnyebbé és alakíthatóbbá válik. Folteltávolítás és szövetfehérítés esetén ezek az oxidálószerek szerves molekulák, például zsírok és színezékek oxidációját okozzák.

- Alkoholizátorokban: egy egyszerű eldobható alkáliás készülék egy átlátszó csőből áll, amely kénsavval megnedvesített kálium- és szilícium-dioxid-dikromát-só vizes oldatát tartalmazza; narancssárga színnel keverve. Ez a só az ittas sofőr leheletében lévő alkoholgőzzel érintkezve reagál, a színe zöldre változik. Ez azt jelenti, hogy az etanol (alkohol) etanálissá oxidálódása következik be.

Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/conceito-exemplos-agente-redutor-agente-oxidante.htm

