Hoz periódusos rendszer családok a táblázat függőleges sorozatai és összegyűjtik kémiai elemek hasonló kémiai tulajdonságokkal. Az ilyen hasonlóságok az azonos családba tartozó elemek azonos mennyiségű vegyértékelektronjainak jelenléte miatt következnek be. A családok a reprezentatív elemeket az 1. és 2. csoportba, 13-tól 18-ig, az átmeneti elemeket pedig az 1-12.
Olvasd el te is:Transurán elemek – az ember által létrehozott kémiai elemek, amelyek az urán után következnek a periódusos rendszerben
A cikk témái
- 1 - A periódusos rendszer családjainak összefoglalása
- 2 - Periódusos rendszer családok szervezése
-
3 - A periódusos rendszer családjainak nómenklatúrája
- → A periódusos rendszer reprezentatív elemei
- → Periódusos rendszer átmeneti elemei
- 4 - A periódusos rendszer családjainak kémiai elemei
-
5 - A periódusos rendszer családok főbb jellemzői
- → 1. csoport vagy alkálifémek családja
- → 2. csoport vagy alkáliföldfémek családja
- → 3–12. csoport vagy átmenetifém-család
- → 13. csoport vagy bórcsalád
- → 14. csoport vagy széncsalád
- → 15. csoport vagy nitrogéncsalád
- → 16. csoport vagy oxigéncsalád (kalkogén)
- → 17. csoport vagy halogének családja
- → 18. csoport vagy nemesgázcsalád
-
6 - Periódusos rendszer és elektronikus terjesztés
- → Reprezentatív elemek elektronikus terjesztése
- → Az átmeneti elemek elektronikus elosztása
- 7 - Megoldott feladatok a periódusos rendszer családjairól
Periódusos rendszercsaládok összefoglalása
A családok a függőleges vonalaknak felelnek meg Periódusos táblázat.
Csoportokként is ismert, a periódusos rendszerben a családok 1-től 18-ig vannak számozva.
Az ugyanabba a családba tartozó kémiai elemek hasonló kémiai tulajdonságokkal rendelkeznek.
Az elemek halmazának ismerőssége azzal magyarázható, hogy egyenlő számú vegyértékelektronja van.
A reprezentatív elemeket az 1., 2., 13., 14., 15., 16., 17. és 18. csoportba soroljuk. Mindegyik családnak saját neve van.
Az átmeneti elemek egyetlen családot alkotnak, amely a 3, 4, 5, 6, 7, 8, 9, 10, 11 és 12 csoportokra oszlik.
Ne hagyd abba most... A hírverés után van még valami ;)
Periódusos rendszer családok szervezése
Családok a periódusos rendszerben a táblázat függőleges sorozatai, vagyis az oszlopok. Más néven csoportok, a periódusos rendszer családjai 1-től 18-ig vannak számozva, balról jobbra.
Az ugyanazt az oszlopot elfoglaló kémiai elemeket ugyanabba a családba tartozónak kell tekinteni., kémiai tulajdonságaik hasonlósága miatt, ami abból adódik, hogy azonos számú elektronok nál nél vegyértékhéj. Például a 18. családba tartozó összes kémiai elemnek nyolc elektronja van a vegyértékhéjban (teljes héjban), és ritkán vesz részt kémiai kötések.
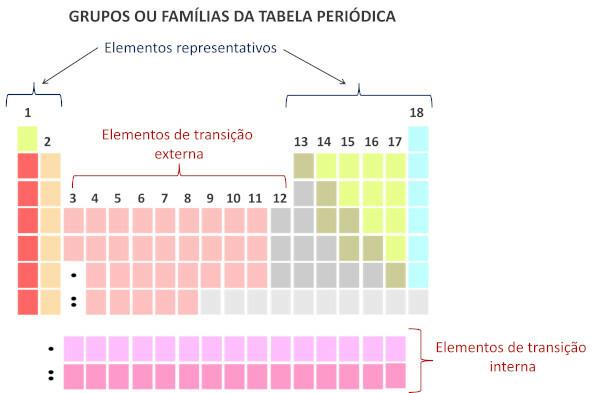
A modern rendszer szerint A Tiszta és Alkalmazott Kémia Nemzetközi Uniója (Iupac), minden csoportot vagy családot egy 1-től 18-ig terjedő szám azonosít, a periódusos rendszerben balról jobbra kezdődően.
Fontos kiemelni, hogy a régi IUPAC rendszer alfanumerikus rendszert alkalmazott, ahol az A és B betűk a reprezentatív, illetve az átmeneti elemekre utalnak. Jelenleg ez a fajta nómenklatúra már nem használatos.
Periódusos rendszer családok nómenklatúrája
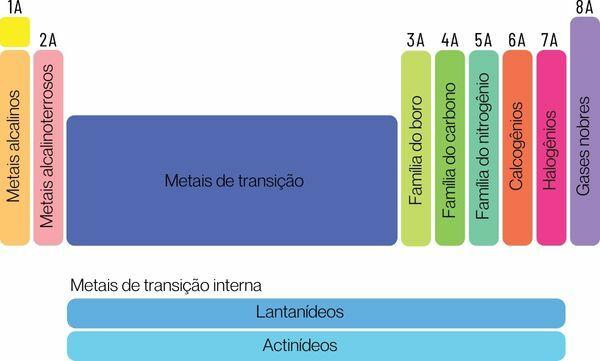
A kémiai elemek két nagy családba sorolhatók: reprezentatív elemek és átmeneti elemek.
→ A periódusos rendszer reprezentatív elemei
A reprezentatív elemeket az 1., 2., 13., 14., 15., 16., 17. és 18. csoportba soroljuk. Ezen csoportok mindegyikének van egy sajátos neve, amelyen szintén ismerhető. Néz:
1. csoport: családja fémek lúgos.
2. csoport: családja alkáliföldfémek.
13. csoport: bór vagy földfém család.
14. csoport: szén-család.
15. csoport: Nitrogén vagy Pnicogens család.
16. csoport: oxigén vagy kalkogén család.
17. csoport: családja halogének.
18. csoport: családja nemesgázok.
→ Periódusos rendszer átmeneti elemei
te átmeneti elemekegyetlen családot alkotnak, 3, 4, 5, 6, 7, 8, 9, 10, 11 és 12 csoportra osztva.. A lantanid és aktinid sorozat is az átmeneti elemek részét képezi.
Az átmeneti elemek mind fémesek és hasonló kémiai tulajdonságokkal rendelkeznek, még ha különböző elektronok is vannak a vegyértékhéjban, és ezért egyetlen és nagy átmenetifém-családot alkotnának.
Kémiai elemek a periódusos rendszer családjaiból
Minden család vagy csoport kémiai elemek halmazából áll. Lásd az egyes családokat alkotó kémiai elemek leírását:
1. csoport:lítium, nátrium, kálium, rubídium, cézium, francium.
2. csoport:berillium, magnézium, kalcium, stroncium, bárium, rádió.
3. csoport:skandium, ittrium, lantanid sorozat és aktinid sorozat.
4. csoport: titán, cirkóniaO, hafnium Ez rutherfordium.
5. csoport:vanádium, nióbium, tantál Ez dubnium.
6. csoport:króm, molibdén, volfrám Ez seaborgium.
7. csoport:mangán, technécium, rénium Ez bohrio.
8. csoport: Vas, ruténium, ozmium Ez hassium.
9. csoport:kobaltródium, irídium és meitnerium.
10. csoport:nikkel, palládium, platina és darmstadtio.
11. csoport: réz, ezüst, Arany és a roentgénium.
12. csoport:cink, kadmium, Higany és Kopernikusz.
13. csoport: bór, alumínium, gallium, indium és tallium.
14. csoport: szén, szilícium, germánium, ón, vezet és flerovium.
15. csoport:nitrogén, foszfor, arzén, antimon Ez bizmut.
16. csoport:oxigén, kén, szelén, tellúr, polónium és livermorium.
17. csoport: fluor, klór, bróm, jód és asztatin.
18. csoport:hélium, neon, argon, kripton, xenon Ez radon.
Fontos: a kémiai elem hidrogén Különleges eset, mivel annak ellenére, hogy az 1. csoport mellett található, nem tartozik az alkálifémek családjába, mivel nem rendelkezik hasonló kémiai tulajdonságokkal.
Többet tud: Melyek a radioaktív elemek a periódusos rendszerben?
A periódusos rendszer családjainak főbb jellemzői
Fémes szilárd anyagok, fényesek és simaak.
Nagy hővezető képességgel és magas Elektromos vezetőképesség.
van hőmérsékletek viszonylag alacsony olvadáspontú.
Nagyon reaktívak vele víz.
Hajlam egyértékű kationok képződésére (töltés +1).
Fémes szilárd anyagok, fényesek és keményebbek az alkálifémekhez képest.
Könnyen oxidálódnak.
Nagy hővezető képességgel és magas elektromos vezetőképességgel rendelkeznek.
Az alkálifémekhez képest valamivel magasabb olvadáspontúak.
Reaktívak vízzel.
Hajlam kétértékű kationok képződésére (töltés +2).
Ők a legnagyobb család a periódusos rendszerben.
Kemény, fényes fémes szilárd anyagok.
Nagy hővezető képességgel és magas elektromos vezetőképességgel rendelkeznek.
Sűrű.
Magas olvadási hőmérséklet.
eltérően jelenhet meg oxidációs állapotok.
→ 13. csoport vagy bórcsalád
Köztes tulajdonságokkal rendelkeznek a fémek tulajdonságai között és nem fémek.
Környezeti körülmények között szilárdak.
Hajlam három vegyértékű kationok képződésére (töltés +3).
→ 14. csoport vagy széncsalád
Köztes tulajdonságokkal rendelkeznek a fémek és a nemfémek tulajdonságai között.
Környezeti körülmények között szilárdak.
Hajlam négy kötés kialakítására.
Környezeti körülmények között szilárdak.
A szén és a szilícium lánckötéseket képezhet.
→ 15. csoport vagy nitrogéncsalád
Köztes tulajdonságokkal rendelkeznek a fémek és a nemfémek tulajdonságai között.
Környezeti körülmények között szilárd halmazállapotú, kivéve a nitrogént, amely gáz.
A nitrogén és a foszfor alapvető fontosságú az élő szervezetekben.
Az arzén erősen mérgező.
→ 16. csoport vagy oxigéncsalád (kalkogén)
Különböző tulajdonságokkal rendelkeznek, nemfémesről fémes elemre változnak, ahogy a család továbbhalad.
Környezeti körülmények között szilárd anyag, kivéve az oxigént, amely gáz.
Hajlam kétértékű anionok képzésére (töltés -2).
→ 17. csoport vagy halogének családja
Ezek nem fémek.
Eléggé reaktív.
Rossz hő- és elektromos vezetők.
Környezeti körülmények között a fluor és a klór mint gázok, a bróm folyékony, a jód pedig szilárd.
Egyértékű anionok képzésére való hajlam (töltés -1).
→ 18. csoport vagy nemesgázcsalád
Ezek nem fémek.
Nagyon kevés reakcióképes, ezért inert gázoknak nevezhetők.
Gázok formájában léteznek.
Nincs hajlamuk a formálódásra ionok.
Periódusos rendszer és elektronikus terjesztés
Az azonos családba vagy csoportba tartozó kémiai elemek hasonló kémiai tulajdonságokkal rendelkeznek, mivel rendelkeznek egyenlő számú elektron a vegyértékhéjban.
A vegyértékhéjban lévő elektronok száma lényeges, hiszen ez határozza meg a kationok képződési hajlamát ill. többek között az anionok, a képződő kémiai kötés típusa, a kémiai reakciókban részt vevő energia jellemzők. A vegyértékelektronok számának meghatározásához szükséges tudni a atomszám az elem, és végezze el elektronikus terjesztés.
→ Reprezentatív elemek elektronikus terjesztése
A reprezentatív elemek legenergiásabb elektronjaik alszinteken vannak s Ez P az elektronikus réteg (n). A következő táblázat az egyes reprezentatív elemek családjához tartozó elektronikus konfigurációkat tartalmazza. a kifejezést n 1 és 7 között változik, és a vegyértékelektronok által elfoglalt energiaszintet jelenti, ami megegyezik a periódusos rendszer periódusával (vízszintes vonallal), amelyben az elem található.
Reprezentatív elemek elektronikus terjesztése | ||
család vagy csoport |
Elektronikus elosztás |
Példa |
1 |
minket1 |
Li (Z=3): 1 s2 2s1 |
2 |
minket2 |
Legyen (Z=4): 1s2 2s2 |
13 |
minket2 np1 |
B (Z=5): 1 s2 2s22p1 |
14 |
minket2 np2 |
C (Z=6): 1 s2 2s22p2 |
15 |
minket2 np3 |
N (Z=7): 1 s2 2s22p3 |
16 |
minket2 np4 |
O (Z=8): 1 s2 2s22p4 |
17 |
minket2 np5 |
F (Z=9): 1 s2 2s22p5 |
18 |
minket2 np6 |
Ne (Z=10): 1s2 2s22p6 |
→ Az átmeneti elemek elektronikus elosztása
Az átmeneti elemek a 3. és 12. csoport között oszlanak meg, ill rendelkezzenek az alszintekkel d Ez f vegyértékelektronok által elfoglalt:
Külső átmenet elemek: a vegyértékelektronokat az alszinten tartani d, miközben az elektronkonfiguráció egyenlő minket2 (n-1)d(1-től 8-ig). Például a nikkel elem (Z = 28) a 10. csoportba tartozik, konfigurációja pedig 1s.2 2s2 2p6 3s2 3p6 4s2 3d8.
Belső átmeneti elemek: a 3. csoport részét képezik, de a periódusos rendszerben „belsőek”, az alatta bővülve, a 6. (lantanidok) és 7. (aktinidák) periódusban. Ezeknek az elemeknek vegyértékelektronjai vannak, amelyek az alhéjat foglalják el f és általános elektronikus konfigurációja minket2 (n-2)f(1-től 13-ig). Például a lantán elem (Z = 57) az első elem a lantanid sorozatban, és elektronkonfigurációja 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f1.
Ismerje meg még:Mi a periódusos rendszer eredete?
Feladatokat oldott meg a periódusos rendszer családjairól
1. kérdés
(UFC – adaptált) Az elemek modern periodikus osztályozásával kapcsolatban jelölje be az igaz állítást:
A) A periódusos rendszerben a családok vagy csoportok vízszintes vonalaknak felelnek meg.
B) Egy család elemei nagyon eltérő kémiai tulajdonságokkal rendelkeznek.
C) Egy családban az elemeknek általában ugyanannyi elektronja van az utolsó héjban.
D) Egy periódusban az elemek hasonló kémiai tulajdonságokkal rendelkeznek.
E) A reprezentatív elemek a 3-tól 12-ig terjedő csoportokban vannak elosztva.
Felbontás:
C alternatíva
Az A tétel hibás: a családok vagy csoportok a periódusos rendszer oszlopai (függőleges vonalai).
B és D pont helytelen: Egy családban az elemek hasonló kémiai tulajdonságokkal rendelkeznek. Időszakokban az elemeknek ugyanaz az elektronhéja van, amelyet vegyértékelektronok foglalnak el.
C pont helyes: Egy családban az elemeknek ugyanannyi elektronja van az utolsó héjban.
Az E tétel hibás: a reprezentatív elemek az 1., 2., 13., 14., 15., 16., 17. és 18. csoport. Az átmeneti elemek a 3-tól 12-ig terjedő csoportokban vannak elosztva.
2. kérdés
(EAM) Az A, B és C elemek vegyértékhéjában a következő elektronkonfigurációk vannak:
V: 3s1
B: 4s2 4p4
C: 3s2
Ezen információk alapján válassza ki a megfelelő lehetőséget.
A) Az A elem egy alkálifém.
B) A B elem halogén.
C) A C elem egy kalkogén.
D) Az A és B elem a periódusos rendszer harmadik periódusához tartozik.
E) A három elem a periódusos rendszer azonos csoportjába tartozik.
Felbontás:
Alternatíva A
Az A elem helyes: az A elem csak egy vegyértékelektront tartalmazó elektronikus eloszlású, ezért a periódusos rendszer 1. csoportjába tartozik.
Helytelen B elem: B elem 4s elektronkonfigurációjú2 4p4, ami azt jelzi, hogy az utolsó héjban 6 elektron van, és ez az elem a 16. csoportba tartozik (kalkogének).
Hibás C elem: C elem elektronikus konfigurációjú, az utolsó héjban 2 elektron van, tehát a táblázat 2. csoportjába tartozik.
Hibás D elem: az A elem a harmadik periódushoz tartozik (n = 3), a B elem pedig a negyedik periódushoz (n = 4).
Hibás E tétel: a három elemnek különböző mennyiségű elektronja van az utolsó héjban, így nem lehetnek ugyanannak a családnak a részei.
Írta: Ana Luiza Lorenzen Lima
Kémia tanár
Kattintson ide, ismerje meg, mi az a vegyértékréteg, és megtudja, hogyan lehet azonosítani.
Ismerje meg, hogyan történik az elektronikus terjesztés, és nézzen meg példákat.
Ismerje meg a belső átmeneti elemek (aktinidák és lantanidok) sajátosságait, amelyek a periódusos rendszer 3. csoportjának hatodik és hetedik periódusát foglalják el.
Ismerje a létező kémiai elemeket, megértse, mik ezek, és hogyan kell ábrázolni őket.
A nemesgázok az egyedüli elemek, amelyek izolált formában találhatók meg a természetben. Tudjon meg többet róluk ebben a cikkben!
Ismerje meg a halogéneket, tulajdonságaikat, jellemzőit és főbb felhasználási területeiket a mindennapi életben.
Tudjon meg többet az alkáliföldfémekről, ismerje meg a jellemzőket, tulajdonságokat és alkalmazásokat.
Ismerje meg, mi az atomszám, és tanulja meg, hogy az atom milyen jellemzői határozhatók meg belőle.
Nézze meg itt, mi a periódusos rendszer, és nézzen meg egy interaktív modellt, amelyből megismerheti az azt alkotó összes kémiai elemet.



