O Schrödinger atommodellje egy elterjedt forma, amelyet a jelölésére használnak az atom leírása a Schrödinger-egyenlet megoldásával, amelyet Erwin Schrödinger osztrák fizikus javasolt 1927-ben. Az egyenlet a kvantummechanikán belül szerzett fontos megfigyeléseken alapul, amelyek robusztus igazolást adnak az atom és az elektron energiájára.
A Schrödinger által kigondolt atom a hullám-részecske kettősségen, a bizonytalanság elvén, többek között a 20. század elején született fogalmakon alapul. Nagy előrelépést hozott az anyag megértésében, mivel megnyitotta az utat a polielektronikus atomok szilárdabb megértéséhez, ami nem lehetséges a Bohr által javasolt atomi modellel.
Olvass te is: Atommodellek – az atom szerkezetének magyarázatára javasolt modellek
A cikk témái
- 1 - Schrödinger atommodelljének összefoglalása
- 2 - Mi a Schrödinger-féle atommodell?
-
3 - Kísérleti alapok a Schrödinger-féle atommodellhez
- Fotoelektromos hatás
- hullám-részecske kettősség
- bizonytalanság elve
- 4 - A Schrödinger atommodell jellemzői
- 5 - A Schrödinger-féle atommodell fejlődése más atommodellekhez képest
Összegzés Schrödinger atommodelljéről
A Schrödinger-féle atommodell valójában az atom és az elektronok leírása a Schrödinger-egyenleten keresztül.
A Schrödinger-egyenletet a kvantummechanika területén végzett fontos tanulmányok fejlesztették ki.
A hullám-részecske kettősség, a bizonytalansági elv, egyéb elméletek mellett elengedhetetlen volt a Schrödinger-egyenlet megalkotásához.
A Schrödinger-egyenlet megoldásával az atom és az elektron energiája is leírható.
A Schrödinger-egyenlet értelmezése alapján látható, hogy az elektronok nem rendelkeznek határozott keringés az atom körül, hanem a körülötte való létezés valószínűségének régiója tőle.
Schrödinger tanulmányai kiterjesztik a A Bohr által javasolt atom megértése, mivel lehetővé teszik a polielektronikus atomok viselkedésének megértését.
Mi a Schrödinger-féle atommodell?
A Schrödinger atommodell a kvantummechanikán alapuló atommodell leírása. Ennek a modellnek a fő jellemzője az elektronok által elfogadott hullám-részecske kettősség matematikai értelmezése, konkrétan az elektron egy jól meghatározott pályájának helyettesítése az elektron létezésének valószínűségével mag.
Ez az értelmezés Erwin Schrödinger osztrák tudós munkásságán keresztül kezdődött 1927-ben, jelentős előrelépések után. az anyag megértésében a kvantummechanika területén, mint például a fotoelektromos hatás, a bizonytalansági elv és a kettősség hullám-részecske.
A Schrödinger-féle atommodell megértése nem triviális, a kémia tanulmányozásának magasabb szintjein közelítik meg.
Ne hagyd abba most... A nyilvánosság után van még valami ;)
Kísérleti alap a Schrödinger-féle atommodellhez
Erwin Schrödinger tanulmányai előtt jelentős előrelépések történtek a az anyag megértése század elején. Ezek a kísérletek indították el a kvantummechanika néven ismert elméleti ismeretek területét, amely értelmezéseket hoz a részecskék atomi léptékhez közeli vagy alatti viselkedéséről. Ebben a sajátos univerzumban a klasszikus fizika, más néven newtoni fizika törvényei gyakran nem érvényesek, vagy nem elegendőek bizonyos viselkedések magyarázatára.
Csak azért, hogy képet kapjunk, elmondhatjuk, hogy a kvantummechanika az ultraibolya katasztrófa néven ismert témával kezdődik. A klasszikus fizika szerint a nullától eltérő hőmérsékletű fekete test (forró tárgy) a gamma- és röntgensugárzás mellett intenzív ultraibolya sugárzást bocsát ki.
Ez azt jelenti, hogy mi, emberek 36-37 °C-os hőmérsékletünkkel világítanánk a sötétben (az izzás következménye). Mondanom sem kell, ez teljes nonszensz, mert ha így lenne, nem lenne sötétség.
Ebben a kontextusban, 1900-ban Max Planck megalkotta a koncepciót mennyi, amelyet „energiacsomagoknak” fordítanak, hogy megmagyarázzák az anyag és a sugárzás közötti energiacserét. Értelmezése szerint egy alacsony hőmérsékletű testnek (mint mi is) nincs elegendő energiája a nagyfrekvenciás ultraibolya sugárzás kibocsátásához.
Így egy test csak akkor tud nagyfrekvenciás ultraibolya sugárzást kibocsátani, ha megszerezte a minimálisan szükséges energiát. Ebben az állapotban az anyag és a környezet közötti energiacsere sugárzási energiacsomagokon keresztül megy végbe.
Az energiacsomagok a klasszikus fizikához képest is különbséget hoznak. Amikor energiacsomagokról beszélünk, ez a kvantált energiára vonatkozik, azaz specifikus, van korlátok kiszabása. A newtoni fizikában a két objektum között kicserélt energia mennyiségének nincs korlátozása.
Fotoelektromos hatás
Ahhoz, hogy a Planck által javasolt elméletek szilárdabbak legyenek, több bizonyítékra volt szükség. Ebben az összefüggésben megjelent a fotoelektromos hatás., amely az elektronok fémből történő kilökődésével foglalkozik a felületén ultraibolya sugárzás hatására.
Ennek az elméletnek a megfigyelései szerint addig nem lökődnek ki elektronok, amíg a sugárzás el nem ér egy bizonyos, minden fémre jellemző frekvenciát. Ha ezt a frekvenciát elérjük, az elektronok azonnal kilökődnek, és minél intenzívebb a beeső sugárzás frekvenciája, annál gyorsabb lesz a kilökött elektron.
A magyarázatot adott a fotoelektromos hatásra Albert Einstein. Einstein szerint az elektronok kilökésére használt elektromágneses sugárzás (például a fény elektromágneses sugárzás) a következőkből áll: fotonoknak nevezett részecskék, és ráadásul minden foton energiacsomagként is értelmezhető. Planck tanulmányai alapján arra a következtetésre jutottak, hogy az ultraibolya sugárzás fotonjai energikusabbak, mint a látható fény fotonjai.

A fém felületével való ütközéskor a fotonok (az elektromágneses sugárzás alkotóelemei) energiát cserélnek az ott jelenlévő elektronokkal. Ha az elektron által a fotonokkal való ütközésből elnyelt energia elég nagy, akkor kilökődik. Ha többet szeretne megtudni a fotoelektromos effektusról, kattintson a gombra itt.
hullám-részecske kettősség
A fotoelektromos hatás erős alapot hozott annak, hogy az elektromágneses sugárzás részecskékből (fotonokból) áll. Sok más kísérlet azonban azt mutatta, hogy az elektromágneses sugárzás hullámként viselkedik. A kísérletek közül a legszembetűnőbb a diffrakció volt – az a fizikai jelenség, amelyet akkor figyeltek meg, amikor egy hullám akadályba ütközik, vagy más értelmezés szerint a a hullámok képessége az akadályok leküzdésére.
O A fény hullám jellege 1801 óta ismert, amikor Thomas Young angol fizikus egy hasítékkal világított egy sorompóra. Amikor áthalad ezen a résen, a fény diffrakción megy keresztül. Minden résnél, beleértve azt is, hogy a fény áthalad, még akkor is, ha elhajlik, új diffrakción megy keresztül.

Mint ez, el kellett fogadni az elektromágneses sugárzás új viselkedését: a hullám-részecske kettősség. Innentől kezdve Louis de Broglie francia tudós kibővítette ezt a fogalmat, azt sugallva, hogy minden részecskét úgy kell érteni, hogy hullámviselkedése is van.
A de Broglie-hipotézis 1925-ben erősödött meg, amikor Clinton Davisson és Lester amerikai tudósok Germer bebizonyította, hogy az elektronnyaláb képes diffrakciót szenvedni, amikor áthalad egy kristályon. nikkel.
Ez az észlelés elengedhetetlen volt ahhoz, hogy levonjuk azt a következtetést, hogy a nehezebb részecskék, például a molekulák is képesek diffrakción átmenni, és ezért hullámszerű viselkedést mutatni. Ha többet szeretne megtudni a hullám-részecske kettősségről, kattintson a gombra itt.
bizonytalanság elve
A klasszikus fizikában könnyű meghatározni egy részecske pályáját. A kvantumvilágban azonban, amelyben a részecskék is hullámszerűen viselkednek, a pályájuk már nem ilyen pontos. Ez azért nincs értelme egy hullám helyéről beszélni.
Például egy gitáron, amikor egy húrt pengesz, a hullám a teljes hosszában szétterül. Ha egy részecskének ugyanez a viselkedése, akkor még nem lehet pontosan meghatározni a helyét lineáris lendületének ismeretében (a tömeget és a sebességet keverő mennyiség).
Ezért a szintén kettős karakterű elektronnak nincs meghatározott pályája/útvonala az atommag körül, ahogy azt sokan hiszik. Aa kettősség ekkor bizonytalanságot teremt a részecske pontos helyzetével kapcsolatban.
Ez a helyzetmeghatározási bizonytalanság nagyon nehéz testeknél elhanyagolható, atomi méretű, ill. szubatomi, vagyis ha tudod, hogy a részecske egy bizonyos helyen, egy bizonyos pillanatban van, akkor már nem tudod, hol lesz a következőben azonnali.
Ebből a dilemmából fakadt a bizonytalansági elv.Werner Heisenberg német fizikus hozta létre 1927-ben. Ezen elv szerint nem lehet tudni egy részecske helyzetét és lineáris impulzusát hibahatár nélkül, vagyis ha az egyik tulajdonság ismert, a másik nem. Ha többet szeretne megtudni a bizonytalanság elvéről, kattintson a gombra itt.
A Schrödinger-féle atommodell jellemzői
Mivel a részecske kettős jellegéből adódóan már nem lehetett konkrét pályát meghatározni, 1927-ben Erwin osztrák tudós. Schrödinger ezt a pontos pályát hullámfüggvénnyel helyettesítette, amelyet a görög psi (ψ) betű képvisel, ennek a függvénynek az értékei a pozíciótól függően változnak. A hullámfüggvényre példa a szinuszfüggvény x.
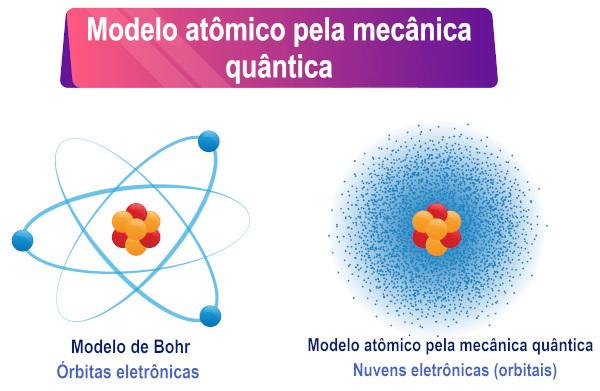
Max Born tudós ezután megalkotta a hullámfüggvény fizikai értelmezését, kijelentve, hogy a a ψ függvény négyzete, azaz ψ², arányos lenne egy részecske megtalálásának valószínűségével egy vidék. Így ψ² alatt egy részecske megtalálásának valószínűségi sűrűségét értjük valamely régióban. Mivel ez egy valószínűségi sűrűség, a ψ² értékét meg kell szorozni a térfogattal, hogy megkapjuk a valódi valószínűséget.
A hullámfüggvény kiszámításához Schrödinger egy egyenletet dolgozott ki, a következőképpen egyszerűsítve:
Hψ = Eψ
A Hψ-t „pszi-hamiltoniként” kell értelmezni, és a hullámfüggvény görbületét írja le. A Hamilton-operátor egy matematikai operátor, akárcsak a plusz, mínusz, log stb. A jobb oldal hozza el nekünk a megfelelő energiát.
Ennek az egyenletnek a megoldása egy fontos következtetésre vezet: a részecskék csak diszkrét energiával rendelkezhetneks, vagyis jól meghatározott energiák, vagy kvantált, és nem bármilyen érték. Ezeket a specifikus energiaértékeket energiaszinteknek nevezzük. Ez a hullámfüggvény előírása, mivel a tér egy meghatározott tartományába kell illeszkednie. A klasszikus mechanikában egy tárgynak tetszőleges összenergiája lehet.
Mint ez, egy elektronnak nem lehet energiája, de jól meghatározott energiaszintek. Mivel a hullámfüggvénynek illeszkednie kell egy térrégióhoz, ne feledje, hogy a Az elektron egy atom belsejében van bezárva az atommaghoz ható vonzási erők révén.
Egy atom energiaszintjeit a Schrödinger-egyenlet megfelelő megoldásával lehet kiszámítani. Ebben az esetben észrevehető, hogy a felbontás egy új egyenletet ér el, ami azt mutatja, hogy az atom minden szintjének energiája egy egész számtól függ, ún. n, ami megerősíti azt az elképzelést, hogy az energiaszinteknek meghatározott értékei vannak.
Így pozitív értékek hozzárendelése a n (1, 2, 3...), ki lehet számítani az atomi szintek energiáját. A paraméter n ma főkvantumszámnak nevezik, mivel végül minden egyes atomszinthez kapcsolódik, amely egy atom számára megengedett.
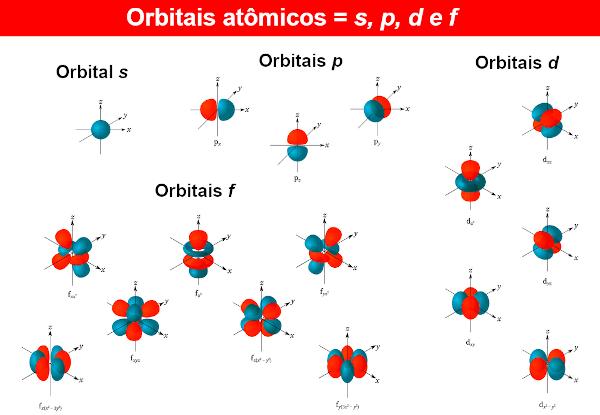
Hoz az elektronhullámfüggvényeket atompályáknak nevezzük, melynek matematikai kifejezéseit szintén a Schrödinger-egyenlet megoldásával kapjuk. Az atomipálya az elektron atomban való eloszlását mutatja be, vagyis az elektron atomban való létezésének valószínűségi tartományát. Az atomi pályák különböző alakúak és energiájúak lehetnek, amelyeket a Schrödinger-egyenlet is kapott.
Minden energiaszinthez n (Erre emlékezve n lehet 1, 2, 3...), vannak n alszintek. Minden alszinten különböző alakú pályák találhatók. A különböző pályáknak nincs határa, de az eddig ismert atomok közül a vegyészek csak négyet használnak belőlük, amelyeket a betűk azonosítanak. s, P, d Ez f.
Tehát például szinten n = 1, csak egy alszint van, tehát csak a pálya van s. Most a szintről n = 2, két alszint van, a pályák jelen vannak s Ez P.
Schrödinger atommodelljének fejlődése más atommodellekhez képest
Mint említettük, Schrödinger nem feltétlenül modellt, hanem matematikai értelmezést mutatott be. a részecskék természetére vonatkozó megfigyelt jelenségekre. Ezért értelmezése bonyolulttá válik, hiszen magának a Schrödinger-egyenletnek is fejlett matematikai ismeretekre van szüksége a feloldásához, sőt értelmezéséhez is.
Azonban a Schrödinger tanulmányai nagy robusztusságot hoztak az atomok és elektronok energiájának igazolására ajándékokat. Például a Schrödinger-egyenlet felbontása megerősíti Bohr atomi modelljét a hidrogénatomra és más hidrogenoid atomokra (azokra, amelyeknek csak 1 elektronja van). Schrödingerhez hasonlóan Bohr is elérte a hidrogénatom megengedett energiaszintjét.
A Bohr-féle atommodell azonban nem képes elérni az 1 elektronnál több atomot tartalmazó atomok elektronszintjét, és ezzel demonstrálja fő gyengeségét. Ha két elektron van jelen, figyelembe kell venni a köztük lévő elektronikus taszítást, amely paraméter hozzáadható a Schrödinger által javasolt matematikai megértéshez.
Schrödinger tanulmányainak másik fontos pontja a kvantumfogalmak adaptálása, például a részecske kettőssége, valamint egy elektron pontos pályája. Az atompálya meghatározása nagyon fontos a megértéséhez minden atom szerkezete. A A valószínűségi sűrűség (ψ²) segít megérteni, hogyan foglalják el az elektronok az atompályákat polielektronikus atomokban, pontosabb információkat hozva az elektron energiájáról.
Írta: Stefano Araujo Novais
Kémia tanár
Tudjon meg többet az atom szerkezetéről és fő alkotó részecskéiről: protonokról, neutronokról és elektronokról.
Ismerje az atommodell fejlődését a történelemben.
Kattintson, és ismerje meg a Rutherford-féle atommodell főbb jellemzőit és a megalkotását lehetővé tevő kísérletet.
Tudja meg, melyek a főbb jellemzők, problémák és milyen szempontok alapján javasolták a Thomson-féle atommodellt!
Lépjen be és találkozzon a Bohr atommal, amely a hidrogénatomot sikeresen leíró posztulátumokon alapuló atomi modell volt.



