A teneso (vagy tennesso), szimbólum Ts, az eleme szám atom A periódusos rendszer 117. sz. Felfedezése nagyon friss volt, 2009-ben, a periódusos rendszerbe csak 2015 végén került fel. A természetben nem található izotóp formájában, ezért laboratóriumban kell előállítani, mivel ezért szintetikus kémiai elem.
A Tennesso tulajdonságait még mindig elméleti kémia és matematikai számítások segítségével tanulmányozzák, tekintettel az alacsony termelési rátára. Előállítása a közötti reakció révén megy végbe 48Ca és a 249Bk, amely lehetővé teszi az elem 294 vagy 293 izotópjának előállítását.
A név az Egyesült Államok Tennessee államára utal, ahol egyes tudósok származnak, akik részt vettek az izotóp felfedezésében és előállításában. 249Bk, nagyon fontos ennek az új elemnek a szintéziséhez.
Lásd még: Bohrium - egy másik szintetikus kémiai elem, amelynek alacsony a termelése
tennesso összefoglaló
A Tenesso egy szintetikus kémiai elem, amely a 17. csoportjába tartozik Periódusos táblázat.
Először 2009-ben szintetizálták, orosz és amerikai tudósok közös munkája során.
Ezt a német tudósok függetlenül megerősítették.
Ez alkotja azt az elemcsoportot, amely legutóbb, 2016-ban szerepelt a periódusos rendszerben.
Vizsgálataik még nagyon frissek, tulajdonságaikat matematikai módszerekkel határozzák meg.
A gyártása az Nukleáris fúzió, ionjainak felhasználásával 48Ca és atomjai 249bk.
A neve az Egyesült Államok Tennessee államára utal.
Ne hagyd abba most... A hirdetés után több is van ;)
tennesso ingatlanok
Szimbólum: Ts.
Atomszám: 117.
Atomtömeg: 293 c.u. vagy 294 c.u. (az Iupac nem hivatalos).
Elektronikus konfiguráció: [Rn] 7s2 5f14 6d10 7p5.
A legstabilabb izotóp:294Ts (51 ezredmásodperc fél élet, amely 38 ezredmásodperccel többet vagy 16 ezredmásodperccel kevesebbet változhat).
Kémiai sorozat: 17. csoport, halogének, szupernehéz elemek.
A Tenesso jellemzői
A tennesso (vagy tennesso), a Ts szimbólum volt az utolsó négy hivatalossá tétel egyike a Nemzetközi Tiszta és Alkalmazott Kémia Szövetség (IUPAC) periódusos rendszerében. A 117-es rendszámmal a 17. csoportban található halogének.
Először 2009 és 2010 között gyártották, de annak Iupac általi megerősítésére csak 2015. december 30-án került sor. Ekkora atomszámú és számú elemei neutronok nem találhatók meg a természetben, és a laboratóriumban kell létrehozni, ezért ez a szintetikus kémiai elem.
A fő ok, amiért nem találhatók meg a természetben, az, hogy rendkívül instabilak. Miután nukleáris reakciók során keletkeztek, átesnek radioaktív bomlás néhány másodperc alatt (néha ennél kevesebb, ezredmásodperces tartományban).
Ezenkívül az olyan elemek, mint a T-k, lassan keletkeznek alacsony hozamú. Konkrétan a tenesso esetében a kutatók 70 napig tartották a reakciót annak érdekében, hogy ennek az elemnek hat atomját észleljék.
Ezért jelenleg a kutatók elméleti számításokkal és matematikai modellekkel próbálják meghatározni a Ts és egyes vegyületeinek alapvető tulajdonságait. Egy ben végzett és publikált tanulmányban Kémiai fizika levelek, Robson Fernandes de Farias brazil kutató megbecsülte a Ts egyes fizikai tulajdonságait és tennesso, TsH, például kovalens sugár, polarizálhatóság, kovalens kötés távolság, valamint kötési energia kovalens.
Többet tud: Oganessone – a periódusos rendszerben a legmagasabb rendszámú kémiai elem
teneso megszerzése
Az olyan szupernehéz elemeket, mint a teneso, az ún forró fúziós reakció (ingyenes fordítása forró fúziós reakció). Ebben a technikában általános az ionok használata 48Ca, stabil izotópja kalcium, amelynek természetes előfordulása 0,2%, és nyolc neutronnal több, mint a hagyományos izotóp.
Ts esetében az ionok 48Ca reagált az izotóppal 249Bk, egy aktinida. Így kezdetben a 297Ts, amely gyorsan lebomlott, és három-négy neutront veszített, így kialakultak az izotópok 294Ts és 293Ts.
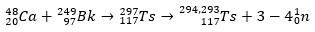
Mindezt ellenőrizni lehetett a α bomlási láncok elemzése, amely elérte a dubnium és röntgen. Mivel a kapott Ts izotópok instabilok, spontán módon α-bomlási reakciókon mennek keresztül, ill. vagyis egy α részecskét bocsátanak ki (amelynek két protonja és két neutronja van), amíg el nem érik a stabil atommagot.
A bomlási nyomvonal segítségével a tudósok össze tudták rakni a puzzle-t, és így megerősítették a szupernehéz elem létezését. az izotóp számára 293Ts, három α bomlás volt a 281Rg, míg az izotóphoz 294A Ts hat α bomlás volt a 270DB
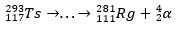
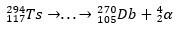
teneso története
117. elem, először orosz és amerikai tudósok széles körű nemzetközi együttműködésével jött létre, amelyre a Flerov Nukleáris Reakciók Laboratóriumában (FLNR) került sor, amely a Nukleáris Kutatási Közös Intézetben található, Dubna városában, Oroszországban.
Figyelemre méltó, hogy ettől függetlenül az eredményeket tovább erősítették német tudósok a Helmhotz Center for Research on Heavy Ions (GSI), Darmstadtban, Németországban. 2009-ben az FLNR kutatócsoportja 70 napon keresztül reagált a 48Ca atomjaival 249Bk így hat atomot kapunk a 117-es elemből. Aztán 2012-ben a tudósoknak sikerült megszerezniük a 117-es elem hét atomját.
A GSI független megerősítése egy másik kísérletnek köszönhető: a tudósok megpróbálták előállítani a 119-es elemet, amely megnyitja a periódusos rendszer nyolcadik periódusát. Ebben az esetben az ötlet az volt, hogy egy ionra reagáljanak 50Téged egy célponttal 249bk. Az erőfeszítések ellenére azonban ezt az elemet négy hónapos próbálkozás után sem észlelték.
A titán ionok megváltoztatása azáltal 48Ca, a GSI tudósai egy ritka, de ismert szupernehéz elem után kutattak, hogy ellenőrizzék kísérleti eljárásaikat. Így végül a 117 elemet szintetizálták, ami arra szolgált, hogy ezt az elemet Iupac megerősítse.
A A tenesso név az Egyesült Államok Tennessee államára utal.Ezzel nemcsak az FLNR-kísérletekben részt vevő tudósok származását tisztelték, hanem arra a helyre is emlékezhettek, ahol az FLNR izotópjai 249A felfedezés szempontjából kulcsfontosságú Bk-t szintetizálták, amikor az Oak Ridge National Laboratory-ban állították elő őket. Angolul az elem neve tennessine, amelynek utótagja a többi halogént kíséri: fluor, klór, bróm, jód, és asztatin.
Teneso-n megoldott gyakorlatokat
1. kérdés
A Tenesso, szimbólum Ts, a halogénatomok csoportjába (17. csoport) legutóbb bekerült elem. Ezért a periodikus tulajdonságok alapján várhatóan hasonló kémiai viselkedést mutat, mint e csoport elemei. Így a következő alternatívák közül kijelenthető, hogy a következő:
A) hat vegyértékelektronja van.
B) a legkisebb atomsugárral rendelkezik az ebbe a csoportba tartozó elemek közül.
C) a legalacsonyabb elektronegativitással rendelkezik az ebbe a csoportba tartozó elemek közül.
D) három elektronra van szüksége a teljes oktett eléréséhez.
Az E) a 17. csoport legnagyobb elektronaffinitása.
Felbontás:
Alternatív C
A Ts-ben, mint a 17. csoport minden elemében, hét elektron van vegyértékréteg, amelynek vegyértékrétege a 7s réteg2 7p5. Ebből arra következtethetünk, hogy az oktett eléréséhez elektronra lenne szüksége, mivel vegyértékhéjában hét elektron van.
A halogének közül a legtöbb elektronhéjjal rendelkező elemként a Ts is a legmagasabb atomsugár, ami kevesebbet garantál elektronaffinitás, mivel a hozzáadott elektronok meglehetősen távol lennének az atommagtól. A legkisebb sugár azt is okozza, hogy a Tennesso a legalacsonyabb elektronegativitással rendelkezik a 17. csoport összes eleme közül.
2. kérdés
A Tenesót, a Ts szimbólumot és a 117-es rendszámot először két izotópjának képződésével mutatták ki: a 293-as és a 294-es tömegű. Így elmondható, hogy a neutronok száma a 293Ts és from 294Ts egyenlő a következőkkel:
A) 293 és 294
B) 117 és 118
C) 177 és 294
D) 176 és 177
E) 176 és 293
Felbontás:
Alternatíva D
A két izotóp neutronszáma a következőképpen határozható meg:
A = Z + n
A a száma tészta atom, Z a protonok száma (atomszám) és n a neutronok száma.
A 293-as izotópot helyettesítve a következőket kapjuk:
293 = 117 + n
n = 293-117
n = 176
A 294-es izotóp esetében:
294 = 117 + n
n = 294-117
n = 177
Írta: Stefano Araújo Novais
Kémia tanár
