| AZ diffúzió egy gáz egy gáz spontán mozgása egy másikon keresztül, vagyis egy másik gáznemű közegben terjed. |
Ez a gázkeverék homogén keverékeket vagy gázhalmazállapotú oldatokat eredményez. Például a gyári kéményekből kilépő gázok, vagy az autók kipufogói a levegőben terjednek atmoszférikus, és az idő múlásával már nem tudtuk megkülönböztetni őket, mivel ezek a gázok diffúzióval léptek fel a levegő.

A kémények által kibocsátott gázok szétszóródnak és „elvesznek” a légköri levegőben, mivel a levegő térfogata sokkal nagyobb, mint a füsté.
| AZ effúzió A gázok diffúziójának egy sajátos típusa, amelyben a gázok kis lyukakon (vagy porózus falakon, azaz kis lyukak halmazán) keresztül szivárognak. |
Például a gyerekeknek árult léggömböket hélium gázzal töltik meg. Idővel ez a gáz végül áthalad a ballon gumipórusain, vagyis ott van a kifolyása. Ezt mutatja, hogy a léggömb néhány óra múlva leereszt.
Ne hagyd abba most... A reklám után van még valami ;)
Thomas Graham skót kémikus 1829-ben tanulmányozta a gázok ezen viselkedését. Arra a következtetésre jutott, hogy az a sebesség, amellyel egy gáz egy másikban diffundál vagy kiáramlik, a sűrűségétől függ. Mivel kísérleti adatait minden gázra megismételte, megalkotta a következő törvényt, amely a nevét viseli:
Graham törvénye: egy gáz diffúziós vagy effúziós sebessége fordítottan arányos a sűrűségének négyzetgyökével.
Matematikailag ez a törvény a következő egyenlettel fejezhető ki:
v α 
Vagy két különböző gázra vonatkoztatva a következőket kapjuk:
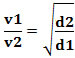
Az ebben az esetben használt mértékegység az „időegység alatt kilépő térfogat”; ezért általában L/perc (liter percenként).
Így a kisebb sűrűségű gázok gyorsabban diffundálnak. Ha azonos hőmérsékletű és nyomású állapotban van, akkor ezt a tömeggel is összefüggésbe hozhatjuk gáz moláris: minél nagyobb a gáz sűrűsége, annál nagyobb a moláris tömege és annál kisebb a sebessége diffúzió; és fordítva. Így a következőkkel rendelkezünk:
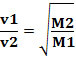
Írta: Jennifer Fogaça
Kémia szakon végzett
Brazil iskolai csapat
Szeretne hivatkozni erre a szövegre egy iskolai vagy tudományos munkában? Néz:
FOGAÇA, Jennifer Rocha Vargas. "Gázok diffúziója és kiáramlása"; Brazil iskola. Elérhető: https://brasilescola.uol.com.br/quimica/difusao-efusao-dos-gases.htm. Hozzáférés dátuma: 2021. július 27.



