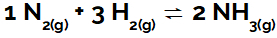entalpia variáció egy fizikai mennyiség, amelyet a ΔH rövidítés képvisel (a görög Δ betű változást jelent, a H betű pedig entalpia), amely az a. által elnyelt vagy felszabaduló energia mennyiségét jelzi kémiai reakció.
Endoterm reakció: amikor az energia elnyelődik;
Exoterm reakció: amikor energia szabadul fel.
Kifejezés az entalpiaváltozás kiszámítására
Mint minden fizikában feldolgozott variációnál, az entalpiaváltozást a végeredmény és a kezdeti eredmény közötti kivonásból határozzuk meg. Mivel a reakció vége a termékeknek, a kezdete pedig a reaktánsoknak felel meg, ezért:
ΔH = Termékek – Reagensek
Mivel minden kémiai anyagnak meghatározott mennyiségű energiája (entalpiája) van, ki kell számítani a entalpia változás, figyelembe kell venni a reakció egyes tagjainak energiamennyiségét, az alábbiak szerint:
Reagensek: ha a reakciónak több terméke van, akkor ezek entalpiáját is hozzá kell adni;
Ha egy reakció a következő egyenletet mutatja be:
A + 2 B →
A reaktánsok entalpiáját úgy kapjuk meg, hogy az A reaktáns entalpiáját hozzáadjuk B entalpiájának kétszereséhez (ez azért van, mert az egyenletben 2 mol B van).
Hr = HA + 2.HB
Termékek: ha a reakció egynél több terméket tartalmaz, akkor ezek entalpiáit össze kell adni;
Ha egy reakció a következő egyenletet mutatja be:
A + 2 B → C + 3D
A reaktánsok entalpiáját a C termék entalpiájának összege adja meg D hármas entalpiájának összegével (ez azért van, mert az egyenletben 3 mol D van).
Hp = HC + 3.HD
Így a kifejezés kiszámításához a entalpia variáció egy kémiai reakció termékeinek entalpiájának és a reaktánsok entalpiájának kivonásával adódik.
ΔH = Hp - Hr
Az entalpia változás eredményének értelmezése
Mivel ez a termékek és a reagensek entalpiája közötti kivonás, az entalpiaváltozás eredménye lehet pozitív vagy negatív.
Negatív: amikor a reaktánsok entalpiája nagyobb, mint a termékeké.
Hr > Hp
Pozitív: amikor a termékek entalpiája nagyobb, mint a reaktánsoké.
Hp > Hr
Az entalpiaváltozás eredményéből a reakciót osztályozhatjuk endoterm vagy exoterm, a következő kritérium szerint:
Endoterm: amikor az eredmény pozitív.
ΔH > 0
Hőtermelő: amikor az eredmény negatív.
ΔH < 0
Példák egy kémiai reakció entalpiaváltozásának meghatározására
1. példa (UFF-RJ): Vegye figyelembe a képződés alapértelmezett entalpiaértékeit (ΔHOf) a KJ.mol-1 25 °C-on a következő anyagokból:
CH4(g) = -74,8
CHCI3. cikk (1) = - 134,5
HCl(g) = - 92,3
A következő reakcióhoz:
CH4(g) + 3Cl2(g) → CHCI3. cikk (1) + 3HCl(g)
A ΔHOf lesz:
a) - 151,9 KJ.mol-1
Ne hagyd abba most... A reklám után van még valami ;)
b) 168,3 KJ.mol-1
c) - 673,2 KJ.mol-1
d) - 336,6 KJ.mol-1
e) 841,5 KJ.mol-1
A reakció entalpiaváltozásának meghatározásához a következő lépéseket kell végrehajtanunk:
1O Lépés: Ellenőrizze, hogy az egyenlet kiegyensúlyozott-e. Ha nem, akkor egyensúlyban kell lennie.
A gyakorlat által szolgáltatott egyenlet kiegyensúlyozott, így van 1 mol CH-unk4 és 3 mol Cl2 a reagensekben, és 1 mol CHCI-t3 és 3 mol HCl a termékekben.
2O Lépés: Számítsa ki a termékek entalpiájának mennyiségét (Hp), a mol-ban kifejezett mennyiséget megszorozza a szolgáltatott entalpiával, majd összeadja az eredményeket:
Hp = CHCI termék3 + HCl termék
Hp = 1,(-134,5) + 3,(-92,3)
LE = -134,5 + (-276,9)
Hp = -134,5-276,9
Hp = -411,4 KJ.mol-1
3O Lépés: Számítsa ki a reaktánsok entalpiájának mennyiségét (Hr), a mol-ban kifejezett mennyiséget megszorozva a megadott entalpiával, majd összeadva az eredményeket:
Megjegyzés: Ahogy a Cl2 egyszerű anyag, ezért entalpiája 0.
Hr = CH reagens4 + Cl reagens2
Hr = 1,(-74,8) + 3,(0)
Hr = -74,8 + 0
Hr = -74,8 KJ.mol-1
4O Lépés: Számítsa ki az entalpiaváltozást az előző lépésekben talált értékek felhasználásával a következő kifejezésben:
HOf = Hp - Hr
HOf = - 411,4 - (-74,8)
HOf = -411,4 + 74,8
HOf = -336,6 KJ.mol-1
2. példa (UEM-PR): Laboratóriumban oxigéngázt lehet előállítani kálium-klorát óvatos melegítésével, a reakció szerint:
2 KClO3(s) → 2KCl(s) + 3O2(g) ΔH= +812 KJ/mol
Feltéve, hogy a KCl entalpiája(s) értéke +486 KJ/Mol, és ha a rendszert 25 °C-on és 1 atm-on figyelembe véve, mi a KClO alapértelmezett entalpiaértéke3(s) KJ/mol-ban?
Az egyenlet egyik összetevőjének entalpiájának meghatározásához az entalpiaváltozás ismeretében a következő lépéseket kell végrehajtanunk:
1O Lépés: Ellenőrizze, hogy az egyenlet kiegyensúlyozott-e. Ha nem, akkor egyensúlyban kell lennie.
A gyakorlat által szolgáltatott egyenlet kiegyensúlyozott, így 2 mol KclO-val rendelkezünk3 a reagensben, és 2 mol KCl-t és 3 mol O-t2 a termékeken.
2O Lépés: Számítsa ki a termékek entalpiájának mennyiségét (Hp), a mol-ban kifejezett mennyiséget megszorozza a szolgáltatott entalpiával, majd összeadja az eredményeket:
Megjegyzés: Ahogy az O2 egyszerű anyag, ezért entalpiája 0.
Hp = KCl+ termék O2
Hp = 2,(+486) + 3,(0)
LE = +972 + 0
Hp = 972 KJ.mol-1
3O Lépés: Számítsa ki a KClO reagens entalpiáját3, a kimutatásban megadott entalpiavariáció és az előző lépésben számított entalpia szorzatok felhasználásával a következő kifejezésben:
HOf = Hp - Hr
812 = 972 - 2.(Ó)
2 óra = 972-812
2 óra = 160
Hr = 160
2
Hr = 80 KJ/mol
Szeretne hivatkozni erre a szövegre egy iskolai vagy tudományos munkában? Néz:
NAPOK, Diogo Lopes. "Mi az entalpiavariáció?"; Brazil iskola. Elérhető: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-variacao-entalpia.htm. Hozzáférés dátuma: 2021. július 27.
Kémia

Hőkémia, entalpia, felszabaduló hő, exoterm reakció, égési reakció, külső környezet, endoterm reakció, reakció kémia, energiacsere, reagensek, fénykibocsátás, fényelnyelés, hő, elektromosság, komponensek, fizikai állapot, Termékek.