Az intermolekuláris erők közül a indukált dipólus által kiváltott dipóluserők csak ezeket nem tanulmányozta Johannes Diederik Van der Waals (1837-1923) holland fizikus. Fritz Wolfgang London (1900-1954) német fizikus tisztázta őket, ezért ezeket az erőket is ún. londoni erők vagy londoni diszperziós erők. Ezeknek az erőknek egy másik elnevezése az pillanatnyi dipól-indukált dipólus.
Ez a fajta erő jelentkezik benne nem poláris anyagokpéldául H2, O2, F2, Cl2, CO2, CH4 és C2H6. És ezek között is előfordulhatnak nemesgáz atomok, amikor közelednek, taszítást okozva elektroszféráik között. Ily módon az elektronok a negatív töltéshiány miatt egy bizonyos oldalon halmozódnak fel, amely negatívan polarizált, a másik oldalon pedig pozitívan.
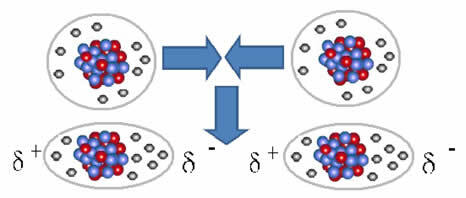
A nempoláris molekulák gáz halmazállapotból – amelyben nagyon távol vannak egymástól, és nincs kölcsönhatás, mivel nincsenek pólusok – folyékony és szilárd halmazállapotba kerülhetnek. Ezekben az aggregációs állapotokban a molekulák közelebb vannak egymáshoz, és az elektronok közötti vonzás vagy taszítás Az atommagok elektronikus felhőik pillanatnyi deformációjához vezethetnek, amelyek pozitív és negatív pólusaiból indulnak ki ideiglenes.
A pillanatnyi dipólusok a szomszédos molekulák polarizációját idézhetik elő, ami vonzó erőket eredményez.
Ez az indukció is előfordulhat. különböző molekulák között és általában ezek az erők gyengébb intenzitásúak mint a dipól-dipól és a hidrogénkötés erőssége. Ezért az ilyen kölcsönhatási erősségű szilárd anyagok, mint a szárazjég (szén-dioxid - CO2) és a jód (I2), amelyek szilárd állapotban vannak, fenségesek (gáz halmazállapotba kerülnek); mert a kölcsönhatásaik megzavarásához szükséges energia kicsi.
Példa a poláris és nem poláris molekulák közötti intermolekuláris erőkre az oxigéngáz (nem poláris) és a víz (poláris) között. Kiderül, hogy a víz negatív vége megközelíti az O2-t, taszítja magát, és így a nem poláris molekula elektronikus felhője eltávolodik. Ezután az oxigén egy pillanatra polarizálódik, és kölcsönhatásba lép a vízzel, feloldódik benne.
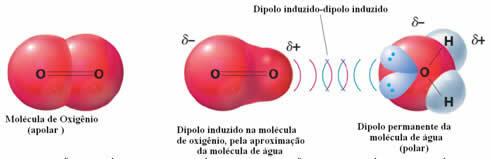
Mivel ezek az erők gyengék, ennek a gáznak az oldhatósága vízben kicsi. Ennek ellenére jelenléte elengedhetetlen a különféle vízi élőlények életének megőrzéséhez.
Ez a kölcsönhatási erő a természetben is előfordul, biztosítva a tapadást a gekkó mancsai és a felület között, amelyen járnak. Ezért tudnak a falakon és a mennyezeten sétálni anélkül, hogy leesnének vagy letapadnának.
Írta: Jennifer Fogaça
Kémia szakon végzett
Brazil iskolai csapat
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/forcas-dipolo-induzido-dipolo-induzido-ou-dispersao-london.htm

