Egy poláris vegyület (vagy anyag) olyan, amelynek két különböző elektronsűrűségű régiója van. Ezen régiók egyike pozitív karakterű (fehér terület), egy másik negatív karakterű (sárga terület), amint azt a következő ábrázolásban láthatjuk:

Különböző töltésű régiók ábrázolása poláris vegyületben
Tudja, ha egy bizonyos kompozit poláris azt jelenti, hogy ismerjük az intermolekuláris erő típusát, amely elősegíti a molekulái közötti kölcsönhatást vagy azokkal más anyagok molekuláira, valamint ezek oldhatóságára és olvadáspontjára vonatkozó feltételezéseket és forró.
Például: ami az oldhatóságot illeti, a poláris vegyületek jól tudnak oldódni poláris vegyületekké. Ami az intermolekuláris erőket illeti, az esettől függően a poláris vegyületek erők által kölcsönhatásba léphetnek permanens dipólus vagy hidrogénkötések (erősség, amely magasabb olvadáspontot is eredményez, ill forró).
Íme két gyakorlati módszer annak meghatározására, hogy egy vegyület poláris-e vagy sem.
Polaritás meghatározása a felhők számán és a ligandumok számán keresztül
Meg tudjuk állapítani, hogy a kompozit poláris a központi atomhoz kapcsolódó egyenlő atomok száma és az adott központi atomban lévő elektronfelhők száma közötti összefüggés alapján.
Jegyzet: Az elektronfelhő bármely kémiai kötés két atom között, vagy egy atom vegyértékhéjából származó elektronpár, amely nem vesz részt a kötésben.
Ha a központi atomban lévő felhők száma eltér a központi atomban lévő egyenlő ligandumok számától, akkor poláris vegyületünk van. A jobb megértéshez kövesse az alábbi példákat:
1. példa: Hidrociánsav molekula
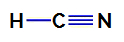
A hidrogén-cianid szerkezeti képlete
A hidrogén-cianidban a központi atom a szén, amelynek négy elektronja van vegyértékréteg a periódusos rendszer IVA családjába való tartozás miatt. Hogyan hoz létre a szén egyetlen kötést (két elektronon osztoznak, mindegyik atomból egy elektronnal részt) hidrogénnel és hármas kötés nitrogénnel, így nincsenek nem kötő elektronok az atomban központi.
Így a hidrogén-cianidban két elektronikus felhő (egy egyszeres kötés és egy hármas kötés) és a másikkal egyenlő ligandum van jelen. Ezért ez a poláris vegyület.
2. példa: Ammónia molekula (NH3)
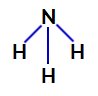
Ammónia szerkezeti képlete
Az ammóniában a központi atom a nitrogén, amelynek vegyértékhéjában öt elektron van, mivel a periódusos rendszer VA családjába tartozik. Mivel a nitrogén egyetlen kötést hoz létre (két elektron osztozik, egy elektron minden érintett atom) minden egyes hidrogénatommal az öt elektron közül kettő nem vesz részt kötésekben.
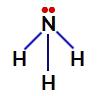
Nem nitrogénkötő elektronok az ammóniában
Így az ammóniában négy elektronfelhő (három egyes kötés és a nem kötő elektronpár) és három egyenlő ligandum (a három hidrogén) található. Tehát ez a poláris vegyület.
Polaritás meghatározása egy vegyület dipólusmomentumvektorán keresztül
Meg tudjuk állapítani, hogy a kompozit poláris elemzésével a kapott dipólusmomentum vektor szerkezeti képletében, figyelembe véve annak molekuláris geometria és a különbség elektronegativitás az érintett atomok között.
Jegyzet: Az elemek elektronegativitásának csökkenő sorrendje: F > O > N > Cl > Br > I > S > C > P > H.
Ha a molekulában jelenlévő vektorok összege nullától eltérő, a vegyület poláris lesz. A jobb megértéshez kövesse az alábbi példákat:
1. példa: triklór-metán molekula
A triklór-metán egy vegyület, amely bemutatja tetraéder geometria, amint azt az alábbi szerkezeti képletében láthatjuk:

A triklór-metán szerkezeti képlete
Ahhoz, hogy megtudjuk, poláris vegyület-e vagy sem, először el kell helyeznünk a dipólusmomentum vektorokat (nyilak, amelyek azt jelzik, hogy melyik atom stabilabb a másiknál), a következő példa szerint:
Jegyzet: A klór elektronegatívabb elem, mint a szén. A szén viszont elektronegatívabb elem, mint a hidrogén.
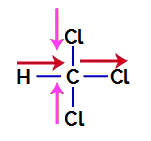
Dipólusmoment vektorok triklór-metánban
A rózsaszínű vektorok +x és -x jellel ábrázolhatók, mivel azonos (függőleges) és ellentétes (fel és le) irányúak. A piros színű vektorokat +x jelöli, mivel azonos irányuk és irányuk van. Így az eredményül kapott dipólusmomentum vektort (a vektorok összegét) a következőképpen ábrázoljuk:
μr = (+x) + (-x) + (+x) + (+x)
μr = +X – x + x + x
μr = 2x
Mivel a kapott dipólusmomentumvektor nem nulla, így van a poláris vegyület.
2. példa: vízmolekula
A víz egy vegyület, amely jelen van szöggeometria, amint azt az alábbi szerkezeti képletében láthatjuk:
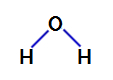
A víz szerkezeti képlete
Ahhoz, hogy megtudjuk, poláris vegyület-e vagy sem, először el kell helyeznünk a dipólusmomentum vektorokat (nyilak, amelyek azt jelzik, hogy melyik atom stabilabb a másiknál), az alábbiak szerint:
Jegyzet: Az oxigén elektronegatívabb elem, mint a hidrogén.
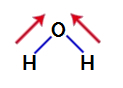
dipólusmomentum vektorok vízben
Mivel a víz szerkezetében a két vektor átlósan van keresztben, a paralelogramma szabályt kell használnunk. Ebben a szabályban, amikor összekapcsoljuk a vektorok alapjait, létrejön egy eredő vektor (amely helyettesíti a korábban használt kettőt), mint a következő modellben:
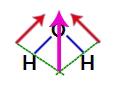
A kapott vektor a víz szerkezeti képletében
Mivel a vízmolekulának egyetlen vektora van, ezért a kapott dipólusmomentum vektor nem nulla, azaz van egy poláris vegyület.
Írta: Én. Diogo Lopes Dias
Forrás: Brazil iskola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-composto-polar.htm
