A termokémia a kémia azon része, amely a kémiai reakciókban részt vevő hő (energia) mennyiségét tanulmányozza.
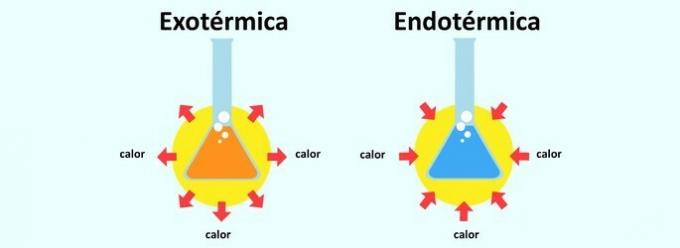
Amikor egy reakció hőt bocsát ki, azt exotermnek minősítik. A hő abszorpciója reakcióban endoterm.
A termokémia néhány fizikai jelenségben, például az anyag állapotának változásában is tanulmányozza az energia átadását.
Termokémia és hő
Kémiai reakciókban az energia felszívódhat vagy felszabadulhat. Ez a hőátadás a legmagasabb hőmérsékletű testről a legalacsonyabb hőmérsékletűre történik.
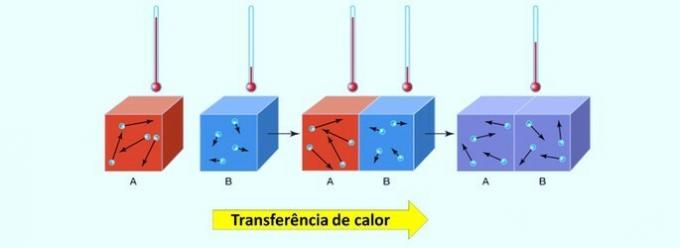
Érdemes emlékezni arra, hogy a hő, más néven hőenergia, olyan fogalom, amely meghatározza a hőenergia cseréjét két test között. O hőmérleg akkor jön létre, amikor a két anyag azonos hőmérsékletet ér el.
Endoterm és exoterm reakciók
ezt hívják endoterm reakció a reakció, amelyben a hő elnyelődik. Ily módon a test elnyeli a hőt abból a környezetből, amelybe beillesztették. Ezért okozza az endoterm reakció a lehűlés érzését.
Példa: Amikor alkoholt dörzsöl a karra, a kar elnyeli ennek az anyagnak a hőjét. De amikor a karon fújunk, miután elfogyasztottuk az alkoholt, egy kis hideget érezünk, olyan érzést, amely az endoterm reakció következménye.
már a exoterm reakció ez fordítva van. Ez a hő felszabadulása, és így az érzés melengető.
Példa: Egy táborban az emberek tűz mellett állnak, hogy a lángok által felszabaduló hő felmelegítse a körülöttük élőket.
A hőcserék a fizikai állapot. Kiderült, hogy a szilárdból folyékonyba és folyadékból gázba történő változás során az eljárás endoterm. Ezzel szemben a gázról folyadékra és folyadékról szilárdra való váltás exoterm.
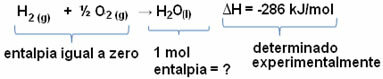
entalpia
Az entalpia (H) az energia energia-abszorpciós és felszabadulási reakciókban cserélődnek, endoterm és exoterm.
Nincs olyan készülék, amely képes lenne az entalpia mérésére. Emiatt mérjük annak variációját (ΔH), amelyet a reagens entalpia (kezdeti energia) és a termék entalpia (végső energia) figyelembevételével végezünk.
Az entalpia leggyakoribb típusai:
| Formáció entalpia | 1 mól anyag képződéséhez szükséges abszorbeált vagy felszabadult energia. |
|---|---|
| Égési entalpia | Kibocsátott energia, amely 1 mol anyag elégetését eredményezi. |
| Link entalpia | 1 mol kémiai kötés megszakadásakor elnyelt energia gáz halmazállapotban. |
Míg az entalpia méri az energiát, entrópia méri a kémiai reakciók rendellenességének mértékét.
Hess-törvény
Germain Henry Hess megállapította, hogy:
Az entalpia változás (ΔH) egy kémiai reakcióban csak a reakció kezdeti és végső állapotától függ, függetlenül a reakciók számától.
Az energia variációját a Hess-törvény szerint a következő képlet segítségével állapíthatjuk meg:
ΔH = Hf - Hén
Hol,
- ΔH: entalpia variáció
- Hf: végső entalpia vagy termékentalpia
- Hén: kezdeti entalpia vagy reagens entalpia
Ebből arra következtetünk, hogy az entalpia változása negatív, ha exoterm reakcióval állunk szemben. Viszont az entalpia variáció pozitív, ha endoterm reakcióval állunk szemben.
Feltétlenül ellenőrizze ezeket a szövegeket, hogy még többet megtudjon a témáról.:
- Termodinamika
- Kalorimetria
- érzékelhető hő
- látens hő
Gyakorlatok kommentált visszajelzéssel
1. (Udesc / 2011) A következő egyenleteket figyelembe véve:
| (A) | 2COg) + O2. g) → 2CO2g) | ΔH = - 565,6 kj |
| (B) | 2CH4Og) + 3O2. g) → 2CO2g) + 4H2O(1) | ΔH = - 1462,6 kj |
| (Ç) | 3O2. g) → 2O3. g) | ΔH = + 426,9 kj |
| (D) | Hit2O3. g) + 3Cs → 2Fes + 3COg) | ΔH = +490,8 kj |
Tekintsük a következő tételeket az egyenletek kapcsán:
ÉN. Az (A) és (B) reakció endoterm.
II. Az (A) és (B) reakció exoterm.
III. A (C) és (D) reakció exoterm.
IV. A (C) és (D) reakció endoterm.
V. A legnagyobb energiakibocsátású reakció a (B).
LÁTTA. A legnagyobb energiakibocsátású reakció (D).
Ellenőrizze a megfelelő alternatívát.
a) Csak a II., III. és az V. állítás igaz.
b) Csak az I., III. és VI. állítás igaz.
c) Csak az I, IV és VI állítás igaz.
d) Csak a II., V. és VI állítás igaz.
e) Csak a II., IV. és V. állítás igaz.
Helyes alternatíva: e) Csak a II., IV. És V. állítás igaz.
a) Rossz. A III. Állítás nem igaz.
A III. Állítással ellentétben a (C) és (D) reakció endoterm, mivel az entalpia variáció pozitív jele a hőfelvételre utal.
b) ROSSZ. Az ebben az alternatívában idézett állítások egyike sem helyes. Tévednek, mert:
- Az (A) és (B) reakció exoterm, mivel az entalpia változás negatív jele a hő felszabadulását jelzi.
- A (C) és (D) reakció endoterm, mivel az entalpia változásának pozitív jele hőelnyelésre utal.
- A (D) reakció nem bocsát ki energiát, mivel endoterm.
c) ROSSZ. Az ebben az alternatívában idézett három állítás közül csak a IV helyes. A másik kettő téved, mert:
- Az (A) és (B) reakció exoterm, mivel az entalpia változás negatív jele a hő felszabadulását jelzi.
- A (D) reakció nem bocsát ki energiát, az entalpia változásának pozitív jele azt jelzi, hogy a reakció endoterm.
d) ROSSZ. A VI. Állítás nem igaz.
A VI állítással ellentétben a (D) reakció nem bocsát ki energiát, mivel endoterm.
a) HELYES. Az állítások helyesek, mert:
- Az (A) és (B) reakció exoterm, mivel az energiaváltozás negatív.
- A (C) és (D) reakció endoterm, mivel a ΔH értéke pozitív.
- A legnagyobb energiakibocsátású reakció a (B), mivel a kimondás exoterm reakciói közül ez a legmagasabb, negatív előjellel.
Ezek a szövegek segítenek ismereteinek bővítésében:
- Gyakorlatok a termokémiáról
- kémiai átalakulások
- Kémiai reakciók
2. (Enem / 2011) A bab főzésének szokatlan lehetősége a termosz használata. Tegyen egy serpenyőbe egy részét babot és három részt vizet, és hagyja a serpenyőt körülbelül 5 percig forralni, majd az összes anyagot vigye át egy termoszba. Körülbelül 8 órával később a bab megfő.
A bab főzése a termosz belsejében történik, mert
a) a víz reagál a babokkal, és ez a reakció exoterm.
b) a bab továbbra is elnyeli a hőt a környező vízből, mivel ez endoterm folyamat.
c) a figyelembe vett rendszer gyakorlatilag elszigetelt, nem engedi, hogy a bab energiát nyerjen vagy veszítsen.
d) a termosz elegendő energiát biztosít a bab főzéséhez, amint a reakció megkezdődik.
e) a reakcióban részt vevő energia felmelegíti az állandó hőmérsékletet fenntartó vizet, mivel ez exoterm folyamat.
Helyes alternatíva: b) a bab továbbra is elnyeli a hőt a környező vízből, mivel ez endoterm folyamat.
a) Rossz. A kémiai reakciót új anyagok képződése jellemzi, amelyek a bab főzésénél nem fordulnak elő.
b) Helyes. A víz felmelegítésekor hőt nyer, és a termosz nem engedi, hogy ez az energia elvész a környezet számára. Így a bab felszívja a hőt a vízből, és főz, endoterm eljárással.
c) ROSSZ. A rendszer el van szigetelve a külső környezettől. Az üveg belsejében a bab és a víz közvetlenül érintkeznek, és ezért hőcserét hajtanak végre.
d) ROSSZ. A termosz lombik funkciója a rendszer szigetelése, nem engedve, hogy a benne lévő keverék hőcserét végezzen a környezettel.
e) Rossz. A hőmérséklet nem állandó, mivel a víz átadja a hőt a babnak, energiát veszít, amíg a két hőmérséklet meg nem egyezik.
Nézze meg az alábbi szövegeket, és tudjon meg többet a témában tárgyalt témákról:
- Fizikai és kémiai átalakulások
- hő és hőmérséklet
- Hőenergia