Előfordulhat, hogy ugyanannak az elemnek vannak savai, és ennek az elemnek azonos az oxidációs száma (NOX), de a különbség a hidratáció mértékében van.
Például az alábbiakban három savat alkotunk, amelyeket a foszfor (P) elem alkot:
H3POR4 H4P2O7 HPO3
Vegye figyelembe, hogy mindhárom savban a foszfor oxidációs száma +5; a különbség a hidratáció mértékében van.
Ennek alapján ezeket a savakat az előtagok különböztetik meg a nómenklatúrában orto, piro és meta.
A leginkább hidratált savat orto-nak nevezik. A megadott példában az első (H3POR4) nak, nek hívják sav ortofoszforos, mert a leghidratáltabb a három közül. Az orto előtag fogyasztható, ezért legtöbbször ezt a savat hívják csak foszforsav.
A pyro és a meta előtagokat referenciapontként orto-savval használják:
- Pyrus: 2 orto molekula mínusz 1 H molekula2O
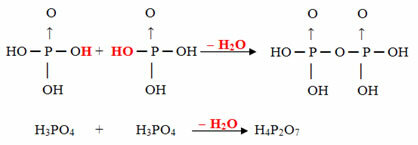
Példa: A H4P2O7 nak, nek hívják sav pirofoszforos mert egyenlő két ortofoszforsavmolekulával (H3POR4) mínusz egy vízmolekula.
2. H3POR4 = H6P2O8
H6P2O8 - H2O = H4P2O7
Ez a folyamat a intermolekuláris dehidráció:
- Cél: 1 orto molekula mínusz 1 H molekula2O
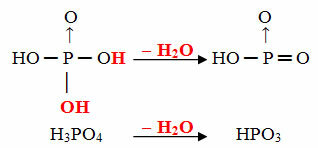
Példa: A HPO3 nak, nek hívják sav célfoszforos mert egyenlő egy ortofoszforsav molekulával (H3POR4) mínusz egy vízmolekula.
H3POR4 - H2O = HPO3
Ez a folyamat a intramolekuláris dehidráció:
Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm

