A redox-reakciók során az elektronok átkerülnek az atomok, ionok vagy molekulák között.
Oxidációs-redukciós reakcióban változnak az oxidációs szám (nox). Az oxi-redukció az oxidációs és redukciós folyamatokból áll:
- Oxidáció: eredmények elektronveszteség és megnövekedett Nox.
- Csökkentés: eredmények elektron nyereség és csökkent a nox.
Amint az egyik elem feladja az elektronokat, egy másik megkapja őket. Így a beérkezett elektronok száma megegyezik az elveszett elektronok teljes számával.
Példák redox reakcióra az égéshez, a korrózióhoz és a fotoszintézishez.
Példák
Az elektront befogadó vagy adományozó elemtől függően a következő nevek vannak:
- Redukálószer: Az oxidáción átesett anyag redukciót okoz és növeli a Nox számát. Ez az, ami elveszíti az elektronokat.
- Oxidálószer: A redukción áteső oxidációt okoz, és csökkentette a NOX számát. Ez nyeri az elektronokat.
O oxidációs szám egy elem elektromos töltését jelenti, amikor részt vesz a kémiai kötés.
Ez az állapot összefügg a elektronegativitás, amely egyes elemek tendenciája az elektronok befogadása.
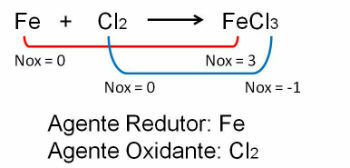
1. Figyelje meg az első példát, vegye figyelembe, hogy a vas és a klór közötti reakcióban változás következik be az oxidációs számban. O klór azáltal, hogy elektronegatívabb, elektronokat nyer:
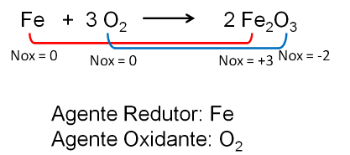
2. A vas és az oxigén reakciója. Az oxigén elektronegatívabb, és végül elektronokat fogad és csökkenti azok oxidációs számát.
Tudjon meg többet, olvassa el még:
- Oxidáció
- Égés
- Kémiai reakciók
- elektronok
A gyakorlat megoldva
1. (PUC-RS) Az oxidációs egyenlet kapcsán - kiegyensúlyozatlan redukció Fe0 + CuSO4 → Fe2(CSAK4)3 + Cu0, elmondható, hogy:
a) a réz oxidációs száma a réz-szulfátban +1.
b) a vasatom 2 elektront veszít.
c) a réz oxidálódik.
d) a vas oxidálószer.
e) a vas oxidálódik.
Felbontás:
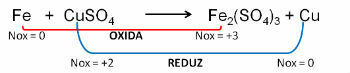
Válasz:
e) a vas oxidálódik.
Feladatok
1. (UFAC-AC) A következő kémiai egyenletben: Zn + 2 HCℓ → ZnCℓ2 + H2
a) a Zn elem oxidálódik és oxidálószerként reagál.
b) a Zn elem redukálószerként oxidálódik és reagál.
c) a Zn elem redukálószerként redukálódik és reagál.
d) a HC2 redukálószer.
e) az egyenlet reverzibilisnek minősül.
b) a Zn elem redukálószerként oxidálódik és reagál.
2. (ITA-SP) Az ionos reakcióban Ni (s) + Cu2+(aq) → Ni2+(aq) + Cu (s)
a) a nikkel az oxidálószer, mert oxidálódik.
b) a nikkel a reduktor, mert oxidálódik.
c) a rézion az oxidálószer, mert oxidálódik.
d) a rézion a reduktor, mert redukálódik.
e) nem redoxireakció, ezért nincs oxidáló vagy redukálószer.
b) a nikkel a reduktor, mert oxidálódik.
3. (UFRGS) A háztartási fehérítőszer aktív hatóanyaga a hipoklorition, a ClO-. Fehérítési folyamatokban ez az ion redukálódik; Ez azt jelenti:
a) a hipoklorit hatásán áteső anyag elektronokat fogad.
b) szerkezetében csökken az elektronok száma.
c) ClO- redukálószer.
d) A ClO- klór- vagy kloridiontá alakul.
e) nem történik elektrontranszfer.
d) A ClO- klór- vagy kloridiontá alakul.