Volumetrikus elemzés vagy volumetria ez egy laboratóriumi eljárás, amelyben bizonyos mennyiségű a megoldás ban ben koncentráció ismert, hogy meghatározzák egy másik oldat koncentrációját. Az ismert koncentrációjú oldat térfogatát akkor határozzuk meg, amikor az teljesen reagál az ismeretlen koncentrációjú oldattal, vagyis az érintett oldatoknak reagálniuk kell egymással.
Az adott térfogat mérésére a legtöbb eszköz a következő:
- Pipetta

Példa a térfogatméréshez használt pipettára
- Burette

A büretta fontos térfogatmérő berendezés
A térfogatmérés az úgynevezett meniszkusz magasságának kiértékelésével történik, amely nem más, mint a folyadék felületi tartománya, amely a tartály vastagságától függően téglalap alakú vagy kupolás alakú (csepp alakú) képet mutat. Minél szélesebb a tartály, annál téglalapabb a meniszkusz; minél vékonyabb a tartály, annál domborúbb lesz. A meniszkusz értékeléséhez a szemnek pontosan a magasságában kell lennie, és referenciaként az alsó régiót kell használnunk, ha a meniszkusz téglalap alakú, vagy a hegyét, ha kidudorodott. Lásd egy értékelés ábráját:
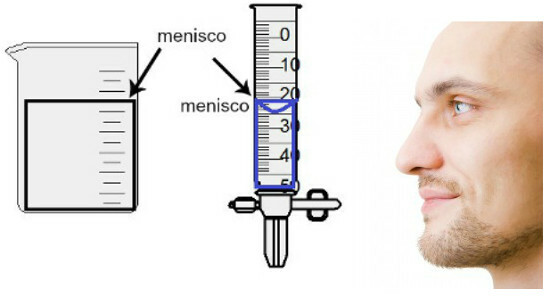
A meniszkusz felméréséhez fontos, hogy a szeme felé nézzen.
A volumetrikus elemzés során a legtöbbet használt berendezés a büretta. Mivel a módszer kémiai reakciókat foglal magában, és ezek gyorsan feldolgozhatók, a büretta lehetővé teszi a folyadék a csúcsán cseppenként szabadul fel, ami lehetővé teszi számunkra, hogy megakadályozzuk a folyadék további kijutását ellenőrzött.
A volumetrián belül az egyik leggyakrabban használt eljárás a titrálás. Ez egy volumetrikus elemzés, amely magában foglalja egy sav és egy bázis közötti reakció előfordulását, vagy fordítva. A megvalósításához szükséges berendezéseket az alábbi kép mutatja:
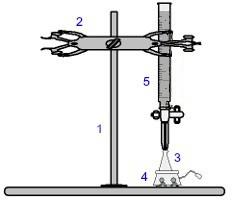
A titráláshoz használt berendezés ábrázolása
A kék számok jelentése:
1) Univerzális támogatás;
2) Karom (a büretta fogására szolgál);
3) Erlenmeyer (ismeretlen koncentrációjú oldatot kap);
4) Mágneses keverő (az Erlenmeyer-lombikban lévő oldat keverésére szolgál);
5) Büretta (ismert koncentrációjú oldatot kap).
Az erlenmeyer-lombikba egy ismeretlen koncentrációjú oldat fenolftalein indikátorral készült térfogatát adjuk (az oldat azonnal rózsaszínűvé válik). A bürettába az ismert koncentrációjú oldat bizonyos mennyiségét helyezzük. Ezután a bürettából származó savoldatot közvetlenül az Erlenmeyer-lombikba csepegtetjük a bázikus oldatba. Ez a csepegtetés addig tart, amíg a bázisoldat színtelenné nem válik, ekkor hívjuk a fordulópontot, ami azt jelzi, hogy az oldatban jelen lévő összes bázis teljesen reagált a savval.
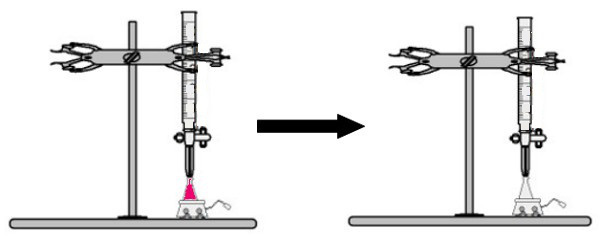
A fordulóponton az oldat már nem rózsaszínű és színtelen
Megfigyelés: Ha az ismeretlen koncentrációjú oldat sav, amikor megkapja a fenolftalein indikátort, színtelen lesz. Így a titrálás fordulópontja az lesz, amikor a savas oldat rózsaszínűvé válik, amikor az alapoldatot a bürettából kapja.
Végül az alapoldat koncentrációjának meghatározásához használja a következő egyenletet:
Ma.Va = Mb.Vb
Ma = savmolaritás;
Va = savtérfogat;
Mb = alap molaritás;
Vb = alaptérfogat.
Most kövessen egy példát arra, hogy hogyan végezzük az ismeretlen molaritású oldat kiszámítását.
1.) 30 ml ismeretlen bázisoldatot adunk egy Erlenmeyer-lombikba annak titrálása céljából, hogy meghatározzuk a koncentrációját (molaritás). A bürettához 50 ml 0,2 mol / l koncentrációjú savoldatot adunk. A savas oldat leejtése és a lúgos oldat titrálásáig azt tapasztaltuk, hogy a titráláshoz 20 ml savoldatot használtunk fel. Határozzuk meg az alkalmazott bázisoldat molaritását.
Gyakorlati adatok:
Vb = 30 ml
Mb =?
Ma = 0,2 mol / l
Va = 20 ml
Mivel a sav molaritása és térfogata 0,2 mol / l és 20 ml, és a felhasznált bázis térfogata 30 ml, csak a titrálási képletet használja:
Ma.Va = Mb.Vb
0,2.20 = Mb.30
4 = Mb.30
4 = Mb
30
Mb = 0,133 mol / l
Általam. Diogo Lopes Dias
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/analise-volumetrica.htm
