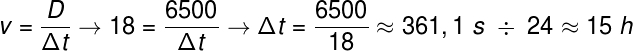A termodinamika harmadik törvénye az anyag viselkedésével foglalkozik egy nullához közeledő entrópiával.
E törvény szerint, amikor egy rendszer termodinamikai egyensúlyban van, entrópiája nullához közelít.
A termodinamika második törvénye az entrópiára vonatkozik. Ezt követően a harmadik törvény a próbáljon meg létrehozni egy abszolút referenciapontot, amely meghatározza az entrópiát.
Walther Nernst (1864-1941) volt a fizikus, aki foglalkozott a termodinamika harmadik törvényének alapját képező elvekkel.
Nernst szerint az entrópia hajlamos lenne minimális értékre, ha egy tiszta anyag hőmérséklete megegyezik az abszolút nullával, vagy megközelíti azt.
Ehhez Nernst az alábbi képletet javasolta, amely megmutatja, hogy az entrópia (ΔS) és a hőmérséklet (T) változása minimális értékekre, azaz 0-ra hajlamos:
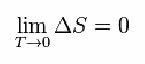
De mi az az Entropia?
Entrópia ez az, ahogy a molekulák rendszereződnek. Ez a szervezet rendellenességként jelentkezik, nem a zavartság, hanem a molekulák mozgása és izgatottsága szempontjából.
Minél több molekula tud mozogni, annál dezorganizáltabbak, annál több entrópiájuk van.
Kezdetben Nernst azt javasolta, hogy az általa javasolt entrópia csak tökéletes kristályokon lehetséges.
Végül arra a következtetésre jutott, hogy az abszolút nullával megegyező hőmérséklet nem létezik, ami a harmadik törvényt ellentmondásos törvénygé teszi.
Tehát sok fizikus számára ez nem törvény, hanem szabály.
Ennyi év után (1912 óta) a tudósok megpróbálják elérni ezt a hőmérsékletet vagy hőmérsékleteket, amelyek egyre közelebb kerülnek az abszolút nullához. Így rájöttek, hogy ez csak gázokban lehetséges, bármilyen szilárd vagy folyékony állapotú anyagot eldobva.
Olvassa el:
- A termodinamika nulla törvénye
- A termodinamika első törvénye
- A termodinamika második törvénye
- Gyakorlatok a termodinamikáról