A Pauling-diagram, más néven energia-diagram, a az elektronikus terjesztés ábrázolása a teljesítmény alszinteken keresztül.
A séma révén Linus Carl Pauling (1901-1994) kémikus valami olyasmit javasolt, ami már ismert volt az elektronok kémiai elemek atomjaiból való eloszlása kapcsán.
A hangulat javítása érdekében Pauling az energiaszinteket javasolta. Rajtuk keresztül lehetséges lenne az atomokat az alapállapotban lévő atom legalacsonyabbtól a legmagasabb energiaszintjéig elrendezni.
Elektronikus terjesztés: Linus Pauling
A Pauling által javasolt modell szerint az elektroszféra 7-re oszlik elektronikus rétegek (K, L, M, N, O, P és Q) az atommag körül, amelyek mindegyike maximális számú elektront tesz lehetővé, amelyek 2, 8, 18, 32, 32,18 és 8.
Nál nél elektronikai disztribúció a energiaszintek, amely először a legalacsonyabb energiaelektront mutatja, amíg el nem éri a legmagasabb energiaelektront.
| Elektronikus rétegek | Az elektronok maximális száma | Energiaszintek | ||||
|---|---|---|---|---|---|---|
| 1 | K | 2 és- | 1s2 | |||
| 2 | L | 8. és- | 2s2 | 2p6 | ||
| 3 | M | 18 és- | 3s2 | 3p6 | 3d10 | |
| 4 | N | 32 és- | 4s2 | 4p6 | 4d10 | 4f14 |
| 5 | O | 32 és- | 5s2 | 5p6 | 5d10 | 5f14 |
| 6 | P | 18 és- | 6s2 | 6p6 | 6d10 | |
| 7 | Q | 8. és- | 7s2 | 7p6 |
A K rétegnek csak egy alszintje van, az L rétegnek két alja van (s és p), az m rétegnek három alszintje van (s, p és d), és így.
Az s alszintek legfeljebb 2 elektron, míg a p alszintek legfeljebb 6 elektront engednek meg. Ezután a d alszint legfeljebb 10 elektront enged meg, míg az f alszint legfeljebb 14 elektront enged meg.
Ne feledje, hogy az egyes alszinteken elektronhéjonként viselkedő elektronok összege a 7 héj mindegyikében a maximális elektronszámot eredményezi.
K: s2 = 2
L és Q: s2 + o6 = 8
M és P: s2 + o6 + d10 = 18
N és O: y2 + o6 + d10 + f14= 32
Akkor fedezte fel Pauling a növekvő energia rend:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Innen az átlós nyilak jelennek meg a diagramban, hogy az elemek elektronikus terjesztését végezzék:
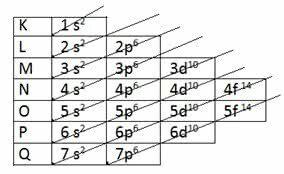 Pauling-diagram
Pauling-diagram
Példa az elektronikus foszforeloszlásra 15P:
1s2 2s2 2p6 3s2 3p3
mint 3-ig2 már összesen 12 elektronunk volt (2 + 2 + 6 + 2), csak 3 további elektronra van szükségünk a 3p alszintről6.
Így megszerezhetjük a szükséges elektronmennyiséget, amennyiben az nem nagyobb, mint 6, ami a 3p alszint maximális száma6 viselkedik.
Olvasd el te is Valencia réteg és Kvantumszámok.
Megoldott gyakorlatok az elektronikus terjesztésről
1. kérdés
(Unirio) „Brazíliában biztonságosabbak a fogimplantátumok, és már megfelelnek a nemzetközi minőségi előírásoknak. A minőségi ugrás a protéziseket alkotó titán csavarok és csapok készítésének folyamatában történt. Titánötvözetből készült protézisekkel fogkoronákat, fogszabályozó eszközöket és fogsorokat rögzítenek az állkapocs és az állkapocs csontjaiban. " (Jornal do Brasil, 1996. október.)
Tekintettel arra, hogy a titán atomszáma 22, elektronikus konfigurációja a következő lesz:
a) 1s2 2s2 2p6 3s2 3p3
b) 1s2 2s2 2p6 3s2 3p5
c) 1s2 2s2 2p6 3s2 3p6 4s2
d) 1s2 2s2 2p6 3s2 3p6 4s2 3d2
e) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
Helyes alternatíva: d) 1s2 2s2 2p6 3s2 3p6 4s2 3d2.
Az elektronok titánban való eloszlásának Linus Pauling-diagramja:
2. kérdés
(ACAFE) Figyelembe véve bármely általános M elemet, amelynek 1s elektronikus konfigurációja van2 2s2 2p6 3s2 3p6 4s2 3d5, elmondható, hogy:
ÉN. atomszáma 25;
II. 7 elektron van az utolsó héjban;
III. 5 párosítatlan elektronja van;
IV. a 7A családhoz tartoznak.
Az állítások helyesek:
a) csak I., II. és III
b) csak I. és III
c) csak a II. és a IV
d) csak az I. és a IV
e) csak a II., III. és a IV
Helyes alternatíva: b) csak I. és III.
ÉN. HELYES Az elektronikus eloszlásban lévő elektronok számát számítva 25-et használtunk. Ezért az atomszám 25, és megfelel a mangán kémiai elemének.
II. ROSSZ. Az utolsó rétegnek, vagyis a legkülső rétegnek 2 elektronja van, ezek a 4-esek2.
III. HELYES A párosítatlan elektronok a d alszintben vannak, amely legfeljebb 10 elektronot képes megtartani, de a mangán elektronikus elosztásában csak 5 elektron van hozzárendelve az alszinthez.
IV. ROSSZ. A mangán a 7B családban és a 4. periódusban található.
3. kérdés
(UFSC) Az elektronok száma a stroncium atom egyes alszintjein (38Sr) az energia növekvő sorrendjében:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
Helyes alternatíva: a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2.
A stroncium elektronok eloszlásának Linus Pauling-diagramja:
Tesztelje tudását még jobban! Szintén megoldja:
- Gyakorlatok az elektronikus terjesztésről
- Gyakorlatok a periódusos rendszeren


