Semlegesítő reakció akkor következik be, amikor egy sav egy bázissal víz és só képződésével reagál. A sav biztosítja a H-ionokat+ és a bázis biztosítja az OH-ionokat- a víz képződéséhez (H2O):
1 óra+(itt) + 1 OH-(itt) → H2O(ℓ)
Ezt a típusú reakciót „semlegesítésnek” nevezik, mert a közeg pH-értékét semlegesítik; a víz pH-ja 7,0 (semleges).
Ahhoz, hogy ezek a reakciók bekövetkezhessenek, szükséges egy bizonyos mennyiségű hő felszabadítása, mivel az energia csak egy része ionokkal képezik azokat a kötéseket, amelyek vízmolekulákat eredményeznek, míg a maradék energia felszabadul a egészen. Ezt a felszabadult energiát nevezzük Semlegesítő entalpia (∆Hsemlegesítés).

Mivel hőt bocsát ki, egzoterm reakcióknak felel meg, amelyekben az entalpia (a rendszer globális energiája) mindig negatív lesz, kevesebb, mint nulla.
Erős savak és erős bázisok közötti reakció esetén a semlegesítő entalpia értéke mindig - 13,8 kcal / mol vagy - 57,7 kJ / mol lesz. Ez azért történik, mert a bázisok és az erős savak teljesen disszociálnak az oldatban, és ezért egyedülik A hő megnyilvánulásáért felelős reakció a víz képződése lesz, amint azt az alábbi három példa mutatja:
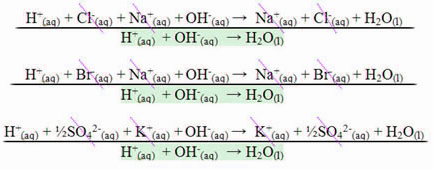
Gyenge savakat vagy bázisokat tartalmazó semlegesítési reakciók esetén a semlegesítő entalpia értéke kevesebb lesz –57,7 kJ / mol.
Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/entalpia-neutralizacao.htm

