Fémek olyan elemek, amelyeket fényerő, szilárdság, hő- és elektromos vezetőképesség jellemez. Ők gyakorlatilag minden ipari folyamatban alkalmazható, szerszámok, ékszerek és érmék gyártásában használt fémötvözetekben és kémiai folyamatokban, például a redoxban, verem és elemeket.
A periódusos rendszerben:
félmércék
átmeneti fémek
alkálifémek
alkáliföldfémek
Az acéliparban a következőkre vannak felosztva:
vasfémek
színesfémek
nehéz fémek
Olvassa el: Melyek a periódusos rendszer új elemei?
Fémjellemzők

Ezek többnyire kiváló hő- és villamosenergia-vezetők.
Fényes megjelenésűek.
magasak sűrűség.
Elektropozitív elemek (hajlamosak kationokat alkotni - pozitív töltések).
Kivéve a Higany, ezek magas olvadáspontú és szobahőmérsékleten szilárd elemek.
Mechanikai szilárdságuk (szívósságuk) van.
Hajlíthatók (törés nélkül formázhatók).
Ne álljon meg most... A reklám után még több van;)
Periódusos rendszerű fémek
alkálifémek
Az elemei a periódusos rendszer első oszlopa, az 1A család. Alkálifémeknek nevezik őket, mert vízzel elkeverve hidroxidokat, azaz lúgos (bázikus) oldatot képeznek.
Ön elemek ebbe a csoportba tartoznak:
Lítium li)
Nátrium (Nál nél)
Kálium (K)
Rubídium (Rb)
Cézium (Cs)
Francium (Fr)
Az alkálifémek elektronikus konfigurációja semleges (töltés nélküli / ionizált) állapotban csak bemutatásra kerül egy elektron az utolsó héjban (vegyértékréteg). O atomsugár és ezeknek a fémeknek a reaktivitása felülről lefelé növekszik (megfigyelve a Periódusos táblázat). Olvadáspontjuk alacsony a többi fémhez képest, alakíthatók és nem túl sűrűek, matt tulajdonságuk van a magas oxidációs potenciál.
Lásd még:Melyek az anyag tulajdonságai?
alkáliföldfémek
Ezek olyan elemek, amelyek a a periódusos rendszer második oszlopa, a 2A család. hívják alkáliföld bázikus (lúgos) jellegű és földi oldatok kialakítására való hajlam által, mivel a 19. század előtt az ezen anyagok által képzett oxidokat így jelölték meg. Ezt a kifejezést olyan oldhatatlan nemfémek jelölésére használták, amelyek melegítés közben nem mentek át mutáción, a 2. csoportba tartozó elemek közös jellemzői. Később az új kutatások és kísérletek fényében kiderült, hogy a „föld” elemek valójában fémek által képzett oxidok voltak.
Ezek képlékeny fémek, kis sűrűségűek két elektron a legkülső héjában, normál hőmérsékleti és nyomási körülmények között, szilárd állapotban találhatók. Ebbe a csoportba tartozik:
Berillium (Lenni)
Magnézium (Mg)
Kalcium (Itt)
Strontium (Mr)
Bárium (Ba)
Rádió (Béka)
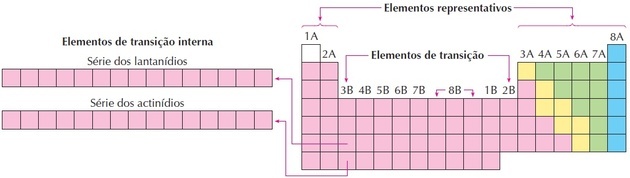
átmeneti fémek
alkotják a a periódusos rendszer B. csoportja, és az alkáliföldfémek és a ametals. Az IUPAC olyan elemként határozta meg őket, amelyeknek hiányos az energéticad energetikai alrétege. A "átmeneti fémek" utal rá átmenet a 2. csoportból a 13. csoportba a periódusos rendszerben és az elektronok növekvő hozzáadása a „d” pályán.
Az átmenetifém-csoport sűrű elemekből áll, magas olvadás- és forrásponttal, és kevésbé reaktív, mint az 1. és 2. csoport fémjei (1A és 2A család). Az átmeneti fémek között szerepel a volfrám, amely a legmagasabb olvadáspontú (3422 ° C) elem, és a higany (Hg), amely olyan fém, amely normál hőmérsékleti és nyomási körülmények között folyékony, olvadáspontja (-38,83 ° C).
Az átmenetifémeknek különféle oxidációs állapota van (NOX változó) és színes anyagokat képeznek.

Belső átmeneti elemek
Belső átmeneti elemek ők:
Lantanidok: olyan elemekből álló sorozatok, amelyek 57–71 protont tartalmaznak, és amelyek a prometium kivételével természetesek.
Aktinidok: csoport, amelyet atomszámban a 89 és 103 közötti elemek alkotnak, és amelyek többnyire szintetikusak. Ez a csoport mind radioaktív rövid felezési idővel.
Ennek a két csoportnak az elemei magas olvadásponttal rendelkeznek, és szobahőmérsékleten mind szilárdak.
Félfémek
Ön félmércék összesen hét elem létezik:
Bór (B)
Szilícium (Si)
Germánium (ge)
Arzén (As)
Antimon (H)
Tellúr (Te)
Polónium (Po)
Ezt a besorolást olyan elemek kapják, amelyek rendelkeznek a fémekre vonatkozó fizikai-kémiai jellemzők, valamint a nemfémes elemek szempontjából relevánsak. A szemimétereknek fénye van, törékeny vegyületek, képesek kationok és anionok képződésére (a körülményektől függően), és köztes vezetők.
Fémek típusai
Vastartalmú: olyan anyagok, amelyek összetételében vasat tartalmaznak. Ők fémötvözetek amelyek közös elemként vasat tartalmaznak, de különböző koncentrációjú formulákkal megfogalmazhatók szén, például különféle technikákkal kovácsolták, így különböző fizikai tulajdonságú termékekkel rendelkeznek.
Színesfém: más típusú fémek által alkotott ötvözetek, mint pl alumínium, réz, nikkel, cink-, titán.
Nehéz fémek: ólom, nikkel, cink, higany. Reaktív, mérgező és bioakkumulatív fémek. Használják elemekben, lámpákban, lőszerekben, többek között háborús tárgyakhoz.
Fémek kémiai kötései
Fémek vannak elemek elektropozitívvagyis hajlamosak kémiai kötésben elveszteni az elektronokat. Amikor egy fém kölcsönhatásba lép egy nem fémmel, akkor ionkötést hajt végre a különbség miatt elektronegativitás. A fémek másik kötési lehetősége a fémkötések.
Nál nél fém csatlakozások fémek között fordul elő, elektronok részleges felszabadulásával és az atomok körül felhő vagy elektrontenger képződésével, ami garantálja a fémrészeknek a vezetőképesség elektromos és alakíthatóság.
Lásd még: Vezetők és szigetelők - mi a különbség?
Fémek beszerzése
A legtöbb fém természetes módon található meg más elemekhez kapcsolódó kőzetek és ásványi anyagok. Számos technika létezik a fémek finomítására, például elektrolízissel és vegyületek különálló kémiai reakcióival.
A fémek esetében a két leggyakrabban alkalmazott módszer ipari méretekben, hogy bizonyos fokú tisztaságot érjen el egy fémben: különbség sűrűség és a mágneses érzékenység (hajlam arra, hogy a fémnek reagálnia kell a mágneses mező).

megoldott gyakorlatok
1. kérdés - (Enem) Az elemekben található kadmium akkor juthat a földre, ha ezeket az anyagokat szabálytalanul helyezik el a környezetben, vagy ha elégetik őket. A fémes formától eltérően a Cd2 + ionok rendkívül veszélyesek a testre, mivel helyettesíthetik A Ca2 + -ionok degeneratív betegséget okoznak a csontokban, nagyon pórusossá teszik őket, és súlyos fájdalmat okoznak a csontokban. ízületek. Gátolhatják a Zn2 + kation által aktivált enzimeket is, amelyek rendkívül fontosak a vesék működése szempontjából. Az ábra egyes fémek és kationjaik sugarának változását mutatja.
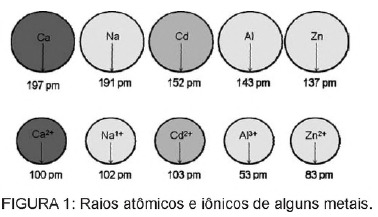
A szöveg alapján a kadmium ionos formájú toxicitása ennek az elemnek a következménye
A) alacsony ionizációs energiával rendelkezik, amely elősegíti az ion képződését és megkönnyíti más vegyületekhez való kötődését.
B) hajlamosak a fémes kationok által közvetített biológiai folyamatokban cselekedni +1 és +3 közötti töltésekkel.
C) sugara és töltése viszonylag közel van a fémionokhoz, amelyek a biológiai folyamatokra hatnak, interferenciát okozva ezekben a folyamatokban.
D) nagy ionsugárral rendelkezik, lehetővé téve a beavatkozást olyan biológiai folyamatokba, amelyekben általában kisebb ionok vesznek részt.
E) +2 töltésű, amely lehetővé teszi a beavatkozást olyan biológiai folyamatokba, amelyekben általában alacsonyabb töltésű ionok vesznek részt.
Felbontás
C. alternatíva A kadmium olyan elem, amely hasonló a fémionokhoz, amelyek természetesen vannak a testben. A kadmium amellett, hogy bioakkumulatív, a fémcsoportokhoz hasonlóan képes kötődni a szulfhidril molekulacsoportokhoz fehérje, ami változásokat okoz a biológiai folyamatokban, például a meszképződésben, valamint a szövetek és a vörösvérsejtek pusztulásában vér.
2. kérdés - A fémekre vonatkozó jellemzőknél jelölje be a helytelen alternatívát.
A) A legtöbb fém jó elektromos és hővezető.
B) Néhány fém hajlamos az oxidációra és / vagy redukcióra.
C) A vas ellenálló és alakítható fém, vagyis könnyen formázható.
D) Az alkáliföldfémeknek ez a neve „föld”, utalva e fémek sötét színű oxidjaira.
E) A fémek változatos színű és tompa elemek, az oxidáció hatására.
Felbontás
E. alternatíva A fémek természetesen fényesek és fémesek, oxidálódhatnak, ami megváltoztatja a fémre jellemző tulajdonságokat része, de ez nem minden fémben előforduló jelenség, és egyes esetekben az oxidáció több tényezőtől függ külső.
írta Laysa Bernardes
Kémia tanár