Akkumulátor olyan eszköz, amelyben elektromos áram keletkezik az a oxidoredukciós reakció, vagyis a reagens egyik faja elektronokat veszít (oxidáció), míg egy másik faj elektronokat (redukció).
Lásd az oxidációs és redukciós reakciók ábrázolását, amelyek bármelyik veremben előfordulnak:
Oxidáció: X → és + X+
Az X faj elveszíti az elektront és kationtá válik.
Csökkentés: Y- + és → Y
az Y anion- elektront nyer és átalakul semleges Y fajokká.
A verem alapkomponensei
A verem alapkomponensei a következők:
Anód: negatív elektróda, amelyben az oxidációs reakció lejátszódik, vagyis elektronveszteség;
Katód: pozitív elektróda, amelyben a redukciós reakció lejátszódik, vagyis elektron nyereség;
Elektrolit-oldat (sóhíd) vagy vezetőképes anyag (például grafitrúd): az az eszköz, amellyel az anód által leadott elektronok elérik a katódot.
Az akkumulátor működésének alapjai
A verem működése a következő eseményekből következik be:
1. alapelv: Anód oxidáció
Az anódban lévő fém, mivel nagyobb az elektronok elvesztésére való hajlam, kationtá válik, amint azt az alábbi egyenletben megfigyeltük:
Zn → Zn2+ + 2 és
2. alapelv: katód redukció
Azok a kationok, amelyek a katódban található anyag részét képezik (példaként rézet fogunk használni), a fogadáskor az anódból származó elektronok rézzé alakulnak át, amint azt az egyenletben láthatjuk ordít:
Szamár2+ + 2e → Cu
első cölöpök
a) Alessandro Volta akkumulátora
Alessandro 1800-ban összeállított cölöpjét (a történelem első halmát) interkalált fémkorongok alkották, amint az az alábbi képen látható:

Alessandro Vissza a halomhoz hasonló összeállítása
A korongokat azért szőtték össze, mert más összetételűek voltak. Az egyik cinkfémből, a másik rézből készült, mindig sós lében áztatott pamut (víz és só által képzett oldat) választotta el.
B) Daniell halma
Daniell 1836-ban összeállított cölöpje két vezető cellával és sóhíddal összekötött félcellából állt.
Félcella 1: az anód volt, vagyis az akkumulátor negatív pólusa.
Cinklemezből állt, és ennek a lemeznek egy részét víz és cink-szulfát (ZnSO4).
2. félcella: ez volt a katód, vagyis az akkumulátor pozitív pólusa.
Rézlemezből állt, és ennek a lemeznek egy részét víz és réz-szulfát (CuSO) alkotta oldatba merítették.4).
sóhíd
U alakú cső, amely víz és kálium-klorid (KCl) által alkotott oldatot tartalmazott, amely összekapcsolta a két félcellát (cink és réz), és mindkét végén üveggyapot volt.
elemek jelenleg
Jelenleg többféle halom van, de általában így néznek ki:
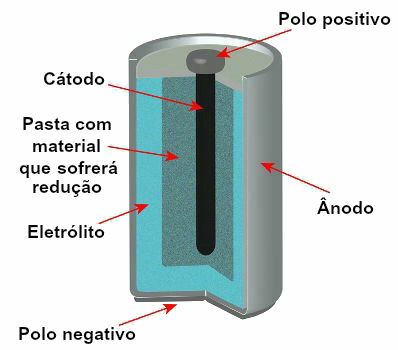
Az aktuális verem modelljét ábrázoló vázlat
A leggyakrabban használt modellek az úgynevezett Leclanché akkumulátor és az alkáli elemek, amelyek a következő különbségekkel bírnak:
A) Leclanche halom
Anódja van, amelyet fém cink alkot;
Katódja ammónium-kloridot, vizet, keményítőt és mangán-dioxidot tartalmazó pasztából áll;
Grafit rúdja van, amely vezetőként szolgál a katódtól az anód felé távozó elektronok számára.
B) Alkáli elem
Anódja van fém cinkből vagy kadmiumból;
Katódja van, amelyet higany-oxid, nikkel-oxid és jód alkot;
A katódot alkotó anyagban vegyes alapnak kell lennie.
Általam. Diogo Lopes Dias
Forrás: Brazil iskola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-pilha.htm

