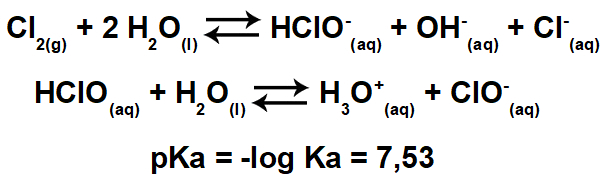A számítás pH fontos erőforrás, amelynek a hallgatónak meg kell határoznia a karakterét. savas, bázikus vagy semleges a megoldás. Ebben a szövegben javaslatot fogunk tenni tippek a pufferoldat pH-jának kiszámításához egyszerű módon.
Figyelemre méltó, hogy a pufferelési megoldás a következő keverékekkel állítható elő:
Gyenge bázisú só keveréke, amelynek ugyanolyan kationban kell lennie, mint a sónak. Ez egy alap puffer;
Egy só keverése egy gyenge savval, amelynek ugyanolyan anionnal kell rendelkeznie, mint a sónak. Ez egy savas puffer.
Menjünk a tippekre ?!
1. tipp: Képletek a pufferoldat típusának megfelelően
Ha van savas pufferoldata, használja:
pH = pKa + log [só]
[sav]
Ha van alap pufferoldata, használja:
pOH = pKb + log [só]
[bázis]
Ha van egy alap pufferoldata és más Kw (vízionizációs állandó), használja:
pH = pKb - pKb - log [só]
[bázis]
2. tipp: Amikor a gyakorlat biztosítja a résztvevők koncentrációját és ionizációs állandó...
Meg lesz az oldatot képező sav vagy bázis koncentrációja;
Megoldjuk a só koncentrációját;
Meg lesz az oldatot képező sav vagy bázis ionizációs állandója (Ka vagy Kb).
Példa: (UNIFOR-CE-adaptált) Tejsav (CH3CH (OH) COOH) és nátrium-laktát (CH3A vizes oldatban lévő CH (OH) COONa) pufferoldatként működik, vagyis gyakorlatilag nem változtatja meg pH-ját H+ vagy ó-. 0,12 mol / l tejsavat és 0,12 mol / l nátrium-laktátot tartalmazó oldat pH-ja az alábbi egyenlettel számítható:
pH = pKa + log [só]
[sav]
Ka = 1,0x10-4 = savionizációs állandó. Az ionizáción áteső sav mennyiségét elhanyagolva határozza meg az oldat pH-értékét.
Felbontás:
Ebben a példában van sóból és savból álló pufferoldat. A megadott adatok:
[só] = 0,12 mol / l
[sav] = 0,12 mol / l
Ka = 1,10-4
JEGYZET: a gyakorlat megadta a Ka-t, de a képletben a pKa-t használjuk, ami egyszerűen - logKa.
Mivel ez savas puffer, csak használja a következő kifejezést:
pH = pKa + log [só]
[sav]
pH = - log 1,10-4 + napló 0,12
0,12
pH = - log10-4 + napló 0,12
0,12
pH = 4. log 10 + log 1
pH = 4,1 + 0
pH = 4
3. tipp: Ha az edzéshez meg kell változtatni annak a pufferoldatnak a pH-ját, amelyhez erős sav vagy bázis került be
A testmozgás biztosítja az azt képző sav vagy bázis koncentrációját;
Megoldjuk a só koncentrációját;
Meg lesz az oldatot képező sav vagy bázis ionizációs állandója (Ka vagy Kb);
A testmozgás biztosítja a puffer pH-értékét az erős sav vagy bázis hozzáadása után;
A sav vagy az erős bázis hozzáadása előtt meg kell találni a puffer pH-értékét;
Ezután a hozzáadás utáni pH-t ki kell vonni a hozzáadás előtti pH-ból.
Példa: (Unimontes-MG) Egy liter pufferoldat 0,2 mol / l nátrium-acetátot és 0,2 mol / l ecetsavat tartalmaz. Nátrium-hidroxid hozzáadásával az oldat pH-ja 4,94-re változott. Figyelembe véve, hogy az ecetsav pKa értéke 4,76 25 ° C-on, mi a változás a pufferoldat pH-jában?
Felbontás: Ebben a példában van egy só és sav által képzett pufferoldat. A megadott adatok:
pH erős bázis hozzáadása után = 4,94
[só] = 0,2 mol / l
[sav] = 0,2 mol / l
pKa = 4,76
Először ki kell számolnunk a puffer pH-ját, mielőtt hozzáadnánk az erős bázist. Ehhez a savas puffer kifejezést kell használnunk:
pH = pKa + log [só]
[sav]
pH = 4,76 + log 0,2
0,2
pH = 4,76 + log 1
pH = 4,76 + 0
pH = 4,76
Végül levonjuk a pH-t a bázis hozzáadása után a pH-ból az adagolás előtt:
ΔpH = után - a bázis hozzáadása előtt
ΔpH = 4,94 - 4,76
ΔpH = 0,18
4. tipp: A puffer pH-értékének kiszámítása, amikor a gyakorlat megadja az egyik résztvevő tömegét
A testmozgás biztosítja az azt képző sav, bázis vagy só koncentrációját vagy mennyiségét;
Amikor a gyakorlat megadja az anyag mennyiségét (mol), akkor megadja a térfogatot is, mert a pH kiszámításakor koncentrációt alkalmazunk (elosztjuk a molot a térfogattal);
Meg lesz az oldatot képező sav vagy bázis ionizációs állandója (Ka vagy Kb);
Ki kell számítani annak a résztvevőnek a moláris tömegét és anyagmennyiségét, amelyiknek a tömeget adták a gyakorlatban.
Példa: (UFES - alkalmazkodva) Oldatot készítünk 0,30 mol ecetsav és 24,6 g nátrium-acetát elegendő mennyiségű vízzel való hozzáadásával 1,0 liter oldat elkészítéséhez. A CH rendszer3COOH és CH3A COONa olyan pufferoldatot jelent, amelyben ez a rendszer egyensúlyban van. Így határozza meg az elkészített oldat pH-ját. (Adatok: Ka = 1,8 × 10-5log 1,8 = 0,26)
Felbontás:
A gyakorlat által szolgáltatott adatok a következők voltak:
Ka = 1,8 × 10-5
log 1,8 = 0,26
Térfogat = 1L
A sav móljainak száma 0,30 mol
-
Mivel a térfogat 1 liter, így a [sav] = 0,30 mol / l
Ne álljon meg most... A reklám után még több van;)
Az alkalmazott só tömege = 24,6 g
Első: Ki kell számolnunk a moláris tömeg (M1) só:
CH3COONa
M1 = 1.12 + 3.1+ 1.12 + 1.16 + 1.16 + 1.23
M1 = 12 + 3 + 12 + 16 + 16 + 23
M1 = 82 g / mol
Második: Most határozzuk meg a só molok számát úgy, hogy elosztjuk a gyakorlat által biztosított tömeget a moláris tömeg megtalált:
n = 24,6
82
n = 0,3 mol
Harmadik: Ki kell számolnunk a moláris koncentráció a só mennyiségét elosztva az anyajegyek számát a szállított mennyiséggel:
M = nem
V
M = 0,3
1
M = 0,3 mol / l
Szoba: A pH-t a savas pufferoldat kifejezése alapján kell kiszámítani:
pH = pKa + log [só]
[sav]
pH = -log 1,8.10-5 + log 0,3
0,3
pH = 5 - log 1,8 + log 1
pH = 5 - 0,26 + 0
pH = 4,74
5. tipp: Egy sav és egy bázis keverésével készített pufferoldat pH-értékének kiszámítása
Meg lesz a savas oldat moláris koncentrációja és térfogata;
Meg lesz a bázikus oldat moláris koncentrációja és térfogata;
Meg lesz a sav vagy a bázis ionizációs állandója;
Határozza meg a készítményben felhasznált sav és bázis mólszámát (szorozva a moláris koncentrációt a térfogattal);
Tartsa tiszteletben a sztöchiometrikus arányt, vagyis a sav minden egyes H + -jához a bázis OH-ját használják semlegesítésre;
Mivel a sav és a bázis semlegesíti egymást és sót képez, tudnunk kell, hogy maradt-e sav (savas puffer) vagy bázis (bázikus puffer);
Határozzuk meg a maradék és a só moláris koncentrációját úgy, hogy mólszámukat elosztjuk a térfogattal (a készítményben felhasznált térfogatok összegével).
Példa: (UEL) A pufferoldatok olyan oldatok, amelyek ellenállnak a pH változásának, ha savakat vagy bázisokat adnak hozzá, vagy amikor hígítás történik. Ezek a megoldások különösen fontosak a biokémiai folyamatokban, mivel sok biológiai rendszer pH-függő. Például megemlítjük az aminosav tripszin amidkötésének enzim általi hasítási sebességétől való pH-függőséget. kimotripszin, amelyben a pH 8 (optimális pH) egy egységének 7-es változása 50% -os hatáscsökkenést eredményez enzimatikus. Ahhoz, hogy a pufferoldat jelentős pufferhatású legyen, összehasonlítható mennyiségű konjugált savval és bázissal kell rendelkeznie. Kémiai laboratóriumban pufferoldatot készítettünk 0,50 liter etánsav (CH3COOH) 0,20 mol L-1 0,50 I nátrium-hidroxiddal (NaOH) 0,10 mol L-1. (Adva: pKa etánsav = 4,75)
Felbontás:
A gyakorlat által szolgáltatott adatok:
[sav] = 0,20 mol / l
Savtérfogat = 0,5 l
[bázis] = 0,10 mol / l
Alaptérfogat = 0,5 l
pKa = 4,75
Első: a sav mólszámának (na) kiszámítása:
na = 0,20. 0,5
na = 0,1 mol
Második: az alap mólszámának kiszámítása:
nb = 0,10. 0,5
nb = 0,05 mol
Harmadik: Határozza meg, hogy ki maradt a megoldásban:
Az etánsavnak csak egy ionizálható hidrogénje van, a bázishoz pedig egy hidroxilcsoport tartozik, így a köztük lévő arány 1: 1. Tehát mindkettő mólszámának meg kell egyeznie, de nagyobb mennyiségű (0,1 mól) savunk van, mint a bázis mennyisége (0,05 mól), így 0,05 mól sav marad meg.
Szoba: A só mólszámának meghatározása
Mivel a képződött só mennyisége mindig a kisebb sztöchiometriai arányú komponensekhez kapcsolódik (kiegyensúlyozó), ebben a példában a só mennyisége az 1. együtthatót követi, vagyis molszáma is 0,5 mol.
Ötödik: A sav és a só moláris koncentrációjának meghatározása
0,5 liter savat összekevertünk 0,5 liter bázissal, így 1 liter térfogatot kaptunk. Tehát a sav és a só koncentrációja 0,05 mol / l.
Hatodik: pH-meghatározás
Mivel a puffer savas, csak használja a következő kifejezés értékeit:
pH = pKa + log [só]
[sav]
pH = 4,75 + log 0,05
0,05
pH = 4,75 + log 1
pH = 4,75 + 0
pH = 4,75
6. tipp: Amikor a gyakorlat megkérdőjelezi az új pH-értéket, miután hozzáadott egy mennyiségű erős savat vagy bázist ...
Megkapjuk a pufferhez adott sav vagy bázis moláris koncentrációjának értékét;
Meg kell adnunk a puffert képező só, sav vagy bázis moláris koncentrációját. Abban az esetben, ha nincs nálunk, csak számolja ki az előző tippek szerint;
A hozzáadott koncentrációt mindig levonják a sav vagy a bázis koncentrációjából;
A hozzáadott koncentráció mindig hozzáadódik a sókoncentrációhoz.
Példa: Határozza meg a pufferoldat pH-ját 0,01 mól NaOH hozzáadása után, tudván, hogy az elkészített oldat 1,0 l-jében 0,05 mol / l ecetsav és 0,05 mol / l nátrium-acetát van. Adatok: (pKa = 4,75, log 0,0666 = 0,1765)
Felbontás:
Megadott adatok:
[só] = 0,05 mol / l
[sav] = 0,05 mol / l
[bázis a pufferhez adva] = 0,01 mol / l
pKa = 4,75
pH = pKa - log (só - bázis)
(sav + bázis)
pH = 4,75 - log (0,05 - 0,01)
(0,05 + 0,01)
pH = 4,75 - log 0,04
0,06
pH = 4,75 - log 0,666
pH = 4,75 + 0,1765
pH = 4,9265
Általam. Diogo Lopes Dias