Nál nél intermolekuláris erők, általánosan hívják Van der Waals erői, itt három van: indukált dipól-indukált dipól, hidrogénkötések és állandó dipól-állandó dipól. Ebben a szövegben csak a három erő közül az utolsót vesszük figyelembe:
A hatalom állandó dipólus-állandó dipólus, vagy egyszerűen dipól-dipól csak ben fordul elő poláris molekulák, vagyis azok, amelyeknek a felületén nincs egyenletes terheléseloszlás. Példaként említve, a HCl-molekulában (sósavgáz) az elektronikus felhő jobban eltolódik a klóratom felé, mivel inkább elektronegatív, mint a hidrogén.
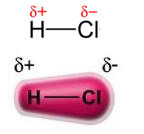
Megjegyezzük, hogy a klóratom körül elektronok halmozódnak fel, ami az a képződését okozza negatív pólus, amelyet a görög delta betű szimbolizál (-δ). Ennek eredményeként a hidrogénatom körüli régióban a pozitív pólus (+δ), mivel alacsony az elektronikus sűrűsége. A HCl molekula ekkor a elektromos dipólus és ezért más szomszédos HCl-molekulákkal érintkezve vonzóerő van a molekulák ellentétes pólusai között, amint az alább látható:
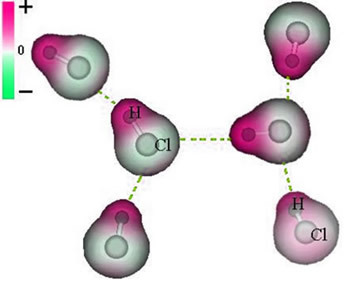
Ez a vonzó erő, amely egy molekula dipóljának negatív vége és egy másik molekula dipóljának pozitív vége között jön létre, alkotja a dipól-dipól erőt..
Tehát, ahogy a neve mondja, a dipólus állandó, tehát csak poláris vegyületekben fordul elő. És minél nagyobb a molekula polaritása, annál intenzívebbek az anyagban a dipól-dipól kölcsönhatások.
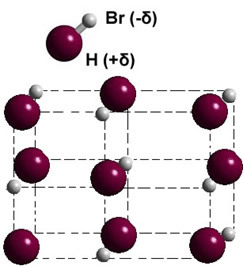
Ha ez szilárd fázisban van, akkor az állandó dipól kialakulása irányítja az egyes molekulák helyzetét a térben, kialakulva dipoláris kristályok; mint az alábbiakban bemutatott hidrogén-bromid esetében:
További példák azokra a poláros anyagokra, amelyek molekula között dipól-dipól erősség van: H2S, CO, HCCl3, CSAK2.
Ez az intermolekuláris erő a közepes intenzitású, mivel erősebb, mint az indukált dipól által kiváltott dipólus vonzereje, de kevésbé intenzív, mint a hidrogénkötés. Ezért olvadáspontjuk és forráspontjuk magasabb, mint azoknak az anyagoknak, amelyek indukált dipólerősséggel rendelkeznek. Mivel az állandó dipólus erő erősebb, több energiát kell szolgáltatni ahhoz, hogy molekulái kölcsönhatásai lebomlanak.
Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm
