A sztöchiometria a kémiai reakcióban részt vevő anyagok mennyiségének kiszámítása.Ez a reakciók törvényei alapján történik, és általában a megfelelő kémiai egyenletek segítségével hajtják végre. Ez a szó, a sztöchiometria a görögből származik: stoikheion = elem, és metron = mérés vagy mérés.
A kémiai reakciók során az anyagok reagálnak egymással, a származó termékek meghatározott arányban. Ily módon kiszámítható, hogy mekkora termék keletkezik, vagy a reakció hozama. Ha bizonyos hozamot akarunk, akkor kiszámíthatjuk azt is, hogy mennyi reagenst kell használni.
Sztöchiometrikus számítások segítségével lehetséges ezek és más specifikus összefüggések létrehozása. De először is tudnunk kell a különböző anyagokat alkotó elemek közötti arányokat. És ezek az arányokat molekuláris képletek, százalékok és a minimális vagy empirikus értékek adják meg.
Ezenkívül bármely reakció együtthatójának alapja a súlytörvények:
- Tömegvédelmi törvény- Zárt rendszerben a reagensek össztömege megegyezik a termékek teljes tömegével;
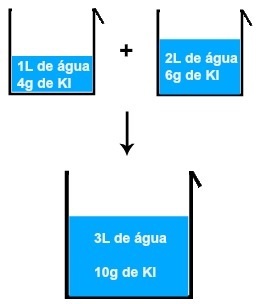
- Állandó arányok törvénye- Minden anyag összetételében állandó tömegarány van.
Továbbá Meleg-Lussac térfogati törvény fontos információkat is szolgáltat számunkra: ha a nyomás és a hőmérséklet nem változik, a reakcióban részt vevő gázmennyiségek egész és kis szám viszonyban vannak egymással.
Ne álljon meg most... A reklám után még több van;)
Az alábbiakban bemutatott összefüggést használjuk a sztöchiometriai számításokban:
1 mol ↔ 6. 1023 molekulák vagy egységképletek ↔ moláris tömeg g / molban ↔ 22,4 L (CNTP-ben*) |
* Normál hőmérsékleti és nyomásviszonyok.
Nézzünk meg egy példát egy sztöchiometrikus számításra, amelyben csak az anyag mennyisége (mol) lesz összefüggésben.
Példa:Mennyi az etil-alkohol anyag mennyisége, C2H6O(1), amelynek reagálnia kell, hogy 12 mol szén-dioxidot nyerjen? Tekintsük ezt teljes égési reakciónak.
Kiegyensúlyozott egyenlet:
Ç2H6O(1) + 3 O2g) → 2CO2. g) + 3 H2Ov.
Ne feledje, hogy 1 mol alkohol 2 mol széndioxidot termel, így a probléma megoldásához egyszerű három szabályt hozhat létre:
1 mol 2 mol
x12 anyajegy
X = 6 mol
Válasz: 12 mol széndioxid előállításához 6 mol etil-alkoholra van szükség.
Ne feledje, hogy a tömeg, a molekulák száma és a moláris térfogat is kapcsolható össze. Mindezekben az esetekben azonban a következő alapvető szabályokat kell betartani:

A sztöchiometrikus számítások alapvető szabályai.
Írta: Jennifer Fogaça
Kémia szakon végzett
Hivatkozni szeretne erre a szövegre egy iskolai vagy tudományos munkában? Néz:
FOGAÇA, Jennifer Rocha Vargas. "Reakció-sztöchiometria"; Brazil iskola. Elérhető: https://brasilescola.uol.com.br/quimica/estequiometria-reacoes.htm. Hozzáférés: 2021. június 27.