Elektrolízis ez egy nem spontán folyamat, vagyis nem természetes módon fordul elő, amelyben az anyagok elektromos kisülés útján képződnek vízben megolvadt vagy feloldott vegyületekben. Ebben a folyamatban egy elektromos áram eljut egy üvegtartályhoz (elektrolitikus tartály), amely két inert elektródával rendelkezik (amelyek nem szenvednek vagy oxidáció sem csökkentés) grafit vagy platina alkotja. Ezek az elektródák elektromos forráshoz vannak csatlakoztatva (általában a dobok) és megolvadt vagy vízben oldott sóba vagy bázisba mártják. Akárcsak a akkumulátorAz elektrolízis katóddal rendelkezik (ahol redukció történik) és anóddal (ahol oxidáció történik).
Összegzés
Az elektrolízis nem spontán folyamat;
Egyszerű vagy összetett anyagok képződhetnek;
Megolvadt oldott anyagnál fordulhat elő (magmás elektrolízis);
Vízben oldott oldott anyagnál fordulhat elő (vizes elektrolízis);
A kation mindig csökken a katódon;
Az anion mindig oxidálódik az anódnál.
Lásd még:Alumínium előállítása elektrolízissel

Az elektrolízis típusai
Ez egy elektrolízis, amely akkor következik be, amikor egy olvadt ionvegyületen elektromos kisülést hajtanak végre. Az ionos vegyületet egy ionos kötés alkotja, például a só vagy a bázis szervetlen. Amikor olvadt vegyületről beszélünk, arra a vegyületre utalunk, amely szilárd állapotból folyékony állapotba kerül.
- Példa magmás elektrolízisre
Amikor elvégezzük a kálium-klorid (KCl) fúzióját, ez a só átesik a disszociációs folyamaton, felszabadítva a kálium-kationt (K+) és a jodid-anion (l-).

Disszociációs egyenlet kálium-kloridhoz
Amikor az elektromos áram ezekkel az ionokkal eljut az elektrolitikus cellába, a káliumkation csökken, fémes kálium (K) képződik, és a jodidanion oxidálódik, szilárd jódot (I2).
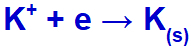
Szilárd káliumképződés egyenlete
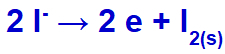
Szilárd jódképző egyenlet
Ez egy elektrolízis, amely akkor következik be, amikor az elektromos kisülést egy só vagy egy szervetlen bázis által képzett vizes oldaton (vízzel rendelkezik) hajtják végre.
- Példa vizes elektrolízisre
Amikor feloldjuk a nátrium-kloridot vízben, az disszociál, és a víz ionizálódik:

Vízionizációs és nátrium-klorid disszociációs egyenletek
Nátrium-kationként (Na+) az IA családba tartozik, a hidronium-kation (H+) áthalad a kisülésen és redukción megy keresztül, hidrogéngázt (H2).
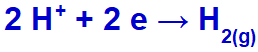
Hidrogéngáz képződés egyenlete
Kloridként (Cl-) nincs oxigénnel (nincs oxigénnel) és nem fluorid (F-), ürül, oxidálódik és klórgázt képez (Cl2).

Klórgáz képződés egyenlete
Szelektív ionkisülés
A vizes közegben (víz és oldott anyag által alkotott oldat) végzett elektrolízis során mindig két kationunk lesz: vízből víz és minden más só disszociáció (példa az oldott anyagra). Két anionunk is lesz: a hidroxil, amely vízből származik, és egy másik, amely sóból származik.

A vízionizáció és a só disszociációjának ionjai
- Szelektív kisülés kationok és anionok számára
Ha az oldott anyag kationja az IA, IIA vagy IIIA családba tartozik, a hidronium (H+) csökken;
Ha az oldott anyagból származó kation nem tartozik a fent említett családokhoz, akkor ez szenved a csökkenéstől.
Ha az oldott anyagból származó anion összetételében oxigén van, vagy fluorid (F-), a hidroxid (OH-) oxidáción megy keresztül;
-
Ha az oldott anyagból származó anion nem rendelkezik a fenti jellemzőkkel, oxidáción megy keresztül.
Ne álljon meg most... A reklám után még több van;)
Ismeretes, hogy a víz képes önionizálni, hidroniumionokat (H+) és hidroxid (OH-), de ez az ionizáció meglehetősen korlátozott. Ezt a tényt bizonyítja, hogy a tiszta víz nem hatékony az elektromos áram vezetésében.
Mint például elektrolízis elektromos kisüléssel jár, a víz elektrolízisének elvégzéséhez fel kell oldani az oldott anyagot, a amely a hidronium és a hidroxid szelektív ürítésének kedvez (amint az a kibocsátásról szóló témában is látható) szelektív).
Ha nátrium-szulfátot (Na2CSAK4), például a közepén lesznek a nátriumkationok (Na+) és hidronium (H+), valamint a hidroxid-anionok (OH-) és szulfát (SO4-2). Így amikor az elektromos áram megérkezik az elektrolitartályba:
a hidronium kisül, redukálódik, mivel a nátrium az IA családba tartozik;
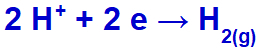
Hidrogéngáz képződés egyenlete
a hidroxid kisül, oxidálódik, mert a szulfát összetételében oxigén van.
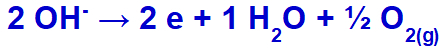
Oxigéngáz képződés egyenlete
Mivel a vízből érkező két ion (kation és anion) ürült, azt mondjuk, hogy a víz elektrolízise megtörtént.
Lásd még: Az elektrolízis mennyiségi vonatkozásai
Egyszerű anyagok, például hidrogéngáz (H2), oxigéngáz (O2) stb .;
Összetett anyagok, például nátrium-hidroxid (NaOH), kénsav (H2CSAK4) stb .;
Egy rész bevonása egy adott fémmel, például rézzel (réz) és arannyal (aranyozás);
Használjon bizonyos fém eltávolítását az ércéből.
Megoldott gyakorlatok az elektrolízisről
1. példa - (Vunesp) CuCℓ vizes oldata2 elektrolízisnek vetik alá platina elektródák alkalmazásával. A helyes állítás:
a) A Cu ion redukció a katódon történik2+.
b) Cu ion oxidáció az anódnál fordul elő2+.
c) A katódnál klórgáz képződik.
d) A platina anód egy része feloldódik, Pt-t képezve2+.
e) Ennek az elektrolízisnek a termékei eltérőek lennének, ha a CuCl elektrolízise2 tüzes volt (fúzió).
a) Helyes. Amikor a CuCl2 vízben oldódik, megvan a hidronium-kation (H+) és réz II (Cu+2). Mivel a réz II kation nem tartozik az IA, IIA és IIIA családokhoz, redukált.
b) Hamis, mivel a klorid-anion (Cl) az anódnál oxidálódik-), amelynek összetételében nincs oxigén és nem fluorid (F-).
c) Hamis, mivel a réz II kation redukciója a katódon történik, ezért a réz fém képződik.
d) Hamis, mivel az elektrolízis során alkalmazott platina vagy grafit elektródok csak villamos energiát vezetnek, ezért nem vesznek részt a folyamatban.
e) Hamis, mint a réz-klorid II magmintás elektrolízise (CuCl2) pontosan ugyanazokat a termékeket mutatná be, mint a vizes, mivel a jelenlévő ionok réz II (Cu+2) és a klorid (Cl-1).
2. példa (UFRN) Vegye figyelembe a következő rendszereket:
ÉN. Olvadt nátrium-klorid;
II. Nátrium-klorid vizes oldata;
III. Olvasztott nátrium-hidroxid;
IV. Nátrium-hidroxid vizes oldata.
Azok, amelyek elektrolízisnek vetik alá a nátriumot, a következők:
a) csak az I. és a II.
b) csak az I. és a III.
c) csak a II. és a IV.
d) csak a III. és a IV.
e) I., II., III. és IV.
Azok a rendszerek, amelyek a katódban termékként fém-nátriumot szolgáltatnak, az I és III.
I - A tápközegben egyetlen kation a nátrium-kation, ezért csak ez képes redukálni és fémes nátriumot képezni.
II- Ez a rendszer nem biztosítja fém nátrium, mivel a nátrium-klorid vízben oldódott, ezért középen nátrium-kationok (Na+) és hidronium (H+) - ez szenvedi el a redukciót, mivel a nátrium az IA családhoz tartozik.
III - A tápközegben egyetlen kation a nátrium-kation (mivel az anyag fúziónak volt kitéve), ezért csak ez redukálódik, és fém nátriumot képez;
IV- Ez a rendszer nem biztosítja fém nátriumot, mert a nátrium-hidroxid vízben oldódott, így középen nátrium-kationok (Na+) és hidronium (H+) - ez szenvedi el a redukciót, mivel a nátrium az IA családhoz tartozik.
Általam. Diogo Lopes Dias