A entalpia (H) meghatározható minden anyag energiatartalmaként vagy egy rendszer teljes energiájaként. A gyakorlatban azonban nem lehet meghatározni egy anyag entalpiáját. Tehát, amit általában mérnek, az a entalpia variáció 

Itt elemezzük az entalpia variációját az exoterm reakciókban (az „exo” szó a görögből származik és azt jelenti, hogy „ki, ki, ki”), amelyek azok a reakciók, amelyekben hőelválasztás történik. A mindennapi életben számos példa van ezekre a reakciókra, mint például az égés és az oltatlan mész és víz keveréke.
Ezekben az esetekben az entalpia variációja 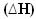 pontosan a felszabadult hőmennyiség lesz, amelyet a végső entalpia és a kezdeti entalpia (Hf - Hén), vagy mivel ez egy reakció, a termékek entalpiaértéke mínusz a reagenseké (HP - HR).
pontosan a felszabadult hőmennyiség lesz, amelyet a végső entalpia és a kezdeti entalpia (Hf - Hén), vagy mivel ez egy reakció, a termékek entalpiaértéke mínusz a reagenseké (HP - HR).
A hő felszabadulásával az energia elvész. Így a rendszer teljes energiája csökken, így a termékek entalpiája mindig alacsonyabb lesz, mint a a reagensekből, így az exoterm reakciók entalpia-változása mindig negatív lesz, kisebb, mint nulla 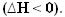
Ne álljon meg most... A reklám után még több van;)
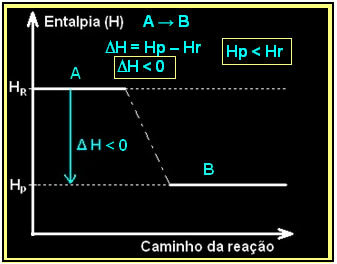
Figyelembe véve egy általános exoterm reakciót:
| A → B + hő |
Ezt az alábbihoz hasonló entalpia diagram segítségével fejezhetjük ki:
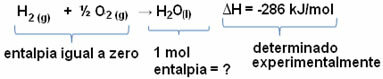
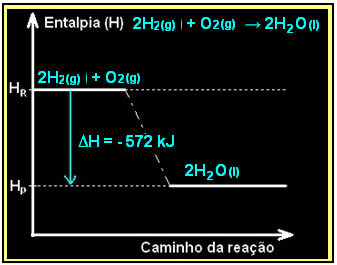
A hidrogéngáz égése folyékony víz képződésével az energia felszabadulásával megy végbe. A rendszer entalpia-variációjának értékét ebben a reakcióban a következők adják meg:
2h2. g) + O2. g) → 2H2O(1)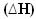 = - 572 kJ
= - 572 kJ
A diagram az alábbiak szerint jelenik meg:
Írta: Jennifer Fogaça
Kémia szakon végzett
Hivatkozni szeretne erre a szövegre egy iskolai vagy tudományos munkában? Néz:
FOGAÇA, Jennifer Rocha Vargas. "Az entalpia változása az exoterm reakciókban"; Brazil iskola. Elérhető: https://brasilescola.uol.com.br/quimica/variacao-entalpia-reacoes-exotermicas.htm. Hozzáférés: 2021. június 28.
Kémia

Termokémia, entalpia, kibocsátott hő, exoterm reakció, égési reakció, külső környezet, endoterm reakció, reakció kémia, energiacsere, reagensek, fénykibocsátás, fényelnyelés, hő, elektromosság, alkatrészek, fizikai állapot, Termékek.