A molekulák polaritása nagyon fontos szempont, mivel az anyagok jellemzőit többek között az a tény határozza meg, hogy molekuláik polárosak vagy nem polárosak.
A molekula polaritásának meghatározása a Dipólmomentum vagy Eredményes dipólus pillanat, amelynek szimbóluma 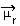 . Ha csak a molekulában lévő egyes kötések dipólus momentumáról beszélünk, akkor a szimbólum a görög mi (µ) betű.
. Ha csak a molekulában lévő egyes kötések dipólus momentumáról beszélünk, akkor a szimbólum a görög mi (µ) betű.

A molekula nem poláros lesz, ha a dipólus nyomatéka egyenlő nullával, de ha nem nulla, akkor azt jelenti, hogy poláris.

Két fontos dolgot kell figyelembe venni az ebből eredő dipólus pillanat meghatározásakor. Lássuk, mik ezek:
1) elektronegativitás különbség a reakcióban részt vevő elemek atomjai között. Például a HF molekula jelentős különbségeket mutat az elektronegativitásban, mivel a fluor sokkal jobban vonzza a kötésben lévő elektronpárt, mint a hidrogén. Így a töltések eloszlása nem szimmetrikus, elektromos dipólusokkal.
Ezt a dipólust egy olyan vektor képviseli, amely a legtöbb elektronra koncentráló végre néz, vagyis a legkevésbé az elektronegatív atomra. Tehát ebben az esetben az egyetlen vektor lesz a kapott vektor, az alábbiak szerint:
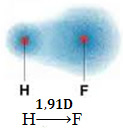
Ne feledje, hogy a vektor értéke megegyezik a dipólus mozzanatával, amelyet debye egységben adunk meg (D = 3,33. 10-30 coulomb. metró). Mivel a dipólus pillanat nem nulla, a molekula és a kötés igen poláris.
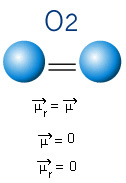
Az alábbi molekulában van egy molekulánk is, amelynek csak két atomja van, azonban ebben az esetben ez egy egyszerű anyagnak felel meg, vagyis csak egy típusú elemből áll. Ezért nincs elektronegativitási különbség; az atomok elektronokat is vonzanak, amelyek szimmetrikusan oszlanak meg. Az eredményül kapott dipólus pillanat egyenlő nullával, tehát a kötés és a molekula egyaránt apoláris.
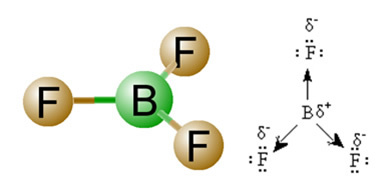
2) Molekula-geometria, vagyis a vektorok térbeli elrendezése. A BF molekula3 három poláris kötése van, amelyekben a fluor a leginkább elektronegatív, így a vektorok felé irányulnak. Mivel azonban az atomok térbeli elrendezése lapos trigonális, ez az elektronok szimmetrikus eloszlását eredményezi a központi atom körül. Így az eredmény az, hogy ez a három vektor megszakítja egymást, és a dipólus nyomatéka nulla. Ezért a BF molekula3 é bocsánatkérés.
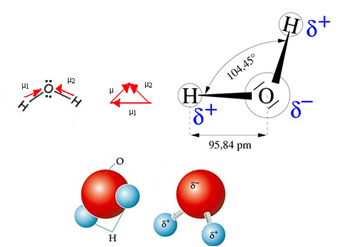
A vízmolekulának két vektora van, térbeli geometriája azonban nem lapos, hanem V alakú. A következő ábrán vegye figyelembe, hogy így a vektoraik nem szüntetik meg egymást, az elektronok aszimmetrikusan oszlanak el, és jobban koncentrálódnak a leginkább elektronegatív atomban, amely oxigén. Így a dipólus pillanat eltér a nullától és a vízmolekula poláris:
Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/momento-dipolar-resultante.htm
