Energijaunutarnja je zbroj kinetičke energije i potencijal povezan s kretanjem sastavnih atoma i molekula tijela. Unutarnja energija također je izravno proporcionalna temperatura tijela. To je skalarna veličina izmjerena u Joulesima (SI) i određena u funkciji varijabli kao što su pritisak (P), volumen (V) i temperatura termodinamika (T) sustava, u Kelvinu (K).
Što je temperatura tijela viša, to je veća njegova unutarnja energija, stoga je veća sposobnost da obavlja neki posao. Nadalje, unutarnja energija monoatomskih plinova, na primjer, daje se isključivo zbrojem kinetička energija svakog atoma plina. Kad se radi o molekularnim plinovima, poput dvoatomnih plinova, treba uzeti u obzir molekularne interakcije i, za ovo, unutarnja energija određena je zbrojem kinetičke energije molekula s potencijalnom energijom koja postoji između oni.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Unutarnja energija idealnih monoatomskih plinova
Kako ne postoji interakcija između atoma idealnog monoatomskog plina, njegova unutarnja energija ovisi isključivo o dvije varijable: broju molova (n) i temperaturi plina (T). Gledati:
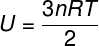
U - unutarnja energija
Ne - broj madeža
R - univerzalna konstanta savršenih plinova
T - temperatura
U gornjoj jednadžbi, R ima modul od 0,082 atm. L / mol. K ili 8,31 J / mol. K (SI). Također, gornju jednadžbu možemo napisati u smislu ostalih veličina, kao što su tlak i zapremina. Za to se moramo sjetiti Clapeyronova jednadžba, koristi se za idealne plinove.
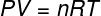
Zamjenjujući gornju jednadžbu prethodnom, imat ćemo sljedeći izraz za izračun unutarnje energije:
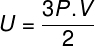
Izgledtakođer:Što je savršen plin?
Uzimajući u obzir gornje jednadžbe, moguće je utvrditi odnos između kinetičke energije atoma idealnog monoatomskog plina i njegove temperature. Zbog toga ćemo ustvrditi da je kinetička energija ove vrste plina čistokinetika. Gledati:
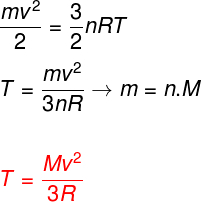
m - tjestenina
Ne - broj mola
M - molekulska masa
U mnogim je situacijama zanimljivo znati izračunati varijaciju unutarnje energije (ΔU) plina, jer ta količina pokazuje da li plin primio je ili predao energije. Ako je varijacija unutarnje energije plina bila pozitivna (ΔU> 0), plin će dobiti energiju; u suprotnom (ΔU <0), plin će se odreći dijela svoje energije.
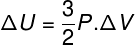
Interna varijacija energije u smislu promjene zapremine plina.
Unutarnja energija za dvoatomske plinove
Za idealne dvoatomske plinove unutarnja energija daje se malo drugačijom jednadžbom.
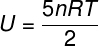
Unutarnja energija u termodinamičkim transformacijama i ciklusima
Prema 1. zakon termodinamike, unutarnja energija idealnog plina može se u određenoj mjeri razlikovati termodinamičke transformacije, ovisno o količini izmjenjene topline između okoline i sustava, kao i o radu koji sustav vrši ili na njemu.
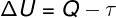
P - toplina
τ - posao
Dalje, pogledajmo oblik koji ovaj zakon ima za neke određene termodinamičke transformacije.
Izgledtakođer:Povijest toplinskih strojeva
→ Unutarnja energija: izotermna transformacija
Na izotermička transformacija, nema promjene temperature i stoga unutarnja energija ostaje konstantna.
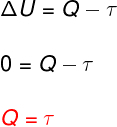
U ovom slučaju, cijela količina topline koja se izmjenjuje sa sustavom pretvara se u rad i obrnuto.
→ Unutarnja energija: izovolumetrijska transformacija
Na izovolumetrijska transformacija, nije moguće izvoditi posao, jer je sustav zatvoren u krut i nerastegljiv spremnik. U ovom slučaju, cjelokupna količina topline koja se izmjenjuje sa sustavom izravno mijenja njegovu unutarnju energiju.
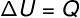
→ Unutarnja energija: izobarna transformacija
U ovoj vrsti transformacije, sustav je podvrgnut a stalni pritisak, stoga se rad njega ili na njemu može analitički izračunati.
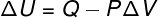
→ Unutarnja energija: adijabatska transformacija
U adijabatske transformacije, nema izmjene topline između sustava i njegove okoline, pa zato promjena unutarnje energije ovisi isključivo o radu koji obavlja sustav ili o njemu.
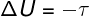
Unutarnja energija u cikličkim procesima
U svakom cikličkom procesu termodinamičko stanje sustava, predstavljeno varijablama tlaka, volumena i temperature (P, V, T), iznosi transformiran, ali se na kraju vraća u izvorno stanje (P, V, T), stoga je promjena unutarnje energije u ovoj vrsti procesa uvijek nula (ΔU = 0).
Izgledtakođer:Cikličke transformacije
Pogledajte donji graf koji prikazuje tri različite termodinamičke transformacije između stanja A i B.
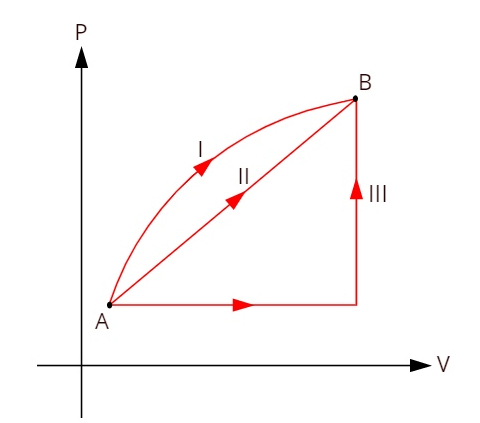
Kako tri transformacije (I, II i III) napuštaju stanje A i prelaze u stanje B, unutarnja varijacija energije mora biti jednaka za sve njih, dakle:
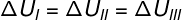
Vježbe unutarnje energije
1) Dva mola idealnog dvoatomskog plina, s molarnom masom jednakom 24 g / mol, nalaze se na temperaturi od 500 K unutar zatvorene, krute posude zapremine jednake 10-3 m³. Odredite:
a) Modul unutarnje energije ovog plina u džulima.
b) Pritisak koji plin vrši na stijenke posude.
Rješenje:
The) Budući da je riječ o idealnom i dvoatomnom plinu, za izračun njegove unutarnje energije upotrijebit ćemo formulu u nastavku:
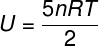
Uzimajući podatke koji su navedeni u izvješću o vježbi, imat ćemo za rješenje sljedeći izračun:
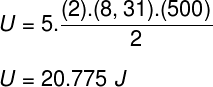
B) Možemo odrediti pritisak koji plin vrši kad znamo koliki je volumen njegove posude: 10-3 m³. Da bismo to učinili, poslužit ćemo se sljedećom formulom:
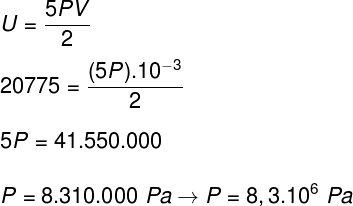
Ja, Rafael Helerbrock