Elektroliza vode sastoji se od razgradnje ove tvari pomoću električne struje i dodavanja elektrolita. Let's bolje razumjeti kako se to događa?
Pročitajte i vi: Što je elektroliza?
Kako se događa elektroliza vode?
Molekule vode sposobne su za samojonizaciju, stvarajući H ione+ (ili H3O+) i oh-:
H2O ↔ H+ + OH-
ili
2 sata2O ↔ H3O+ + OH-
Međutim, voda je vrlo slab elektrolit i unatoč tome što ima ove ione, ne može provoditi električna struja. Dakle, da bi se izvršila njegova elektroliza, odnosno razgradnja pomoću električne struje, potrebno je dodati elektrolit, ionsku otopinu koja može biti sol, baza ili kiselina.

Prioritetni nalog za selektivno ispuštanje
Međutim, kako je objašnjeno u tekstu Vodena elektroliza, u ovom slučaju, nećemo imati samo ione koji dolaze iz vode, već i one tvari koja je u njoj otopljena. U elektrolizi se na elektrodi ispušta samo jedan kation i jedan anion, to jest a selektivno ispuštanje prema redoslijedu prioriteta.
Dakle, da bi katoda i anoda koje se ispuštaju bile vode, a ne otopljene tvari, potrebno je odabrati
kiselina, baza ili sol čiji se ioni lakše ispuštaju iz elektroda od iona u vodi. Da bismo to učinili, moramo se obratiti prioritetnom redu prikazanom u nastavku: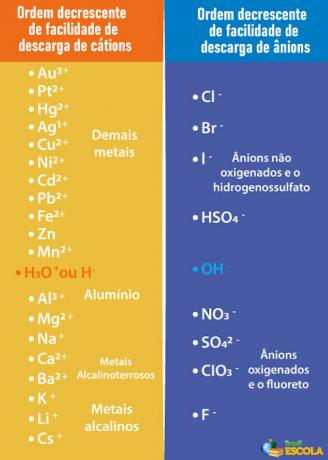
Imajte na umu da su kationi navedeni ispod H+ imaju manje lakoće istovara od njega. U tablici s desne strane vidimo da su anioni ispod OH- imaju manju lakoću istovara. Stoga možemo odabrati, na primjer, sol, bazu ili kiselinu koja tvori ione Na.+, K+, NA3-, SAMO42- i tako dalje, osim što također tvore iste ione kao i voda, to jest H+ i oh-. Neki primjeri su: sumporne kiseline (H2SAMO4), natrijev hidroksid (NaOH) i kalijev nitrat (KNO3).
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Primjer s reakcijama koje su se dogodile u elektrolizi vode
Recimo da se provodi elektroliza vode s dodatkom sumporne kiseline. U ovom ćemo slučaju u sredini imati stvaranje sljedećih iona:
Disocijacija kiseline: 1 H2SAMO4 → 2 h+ + 1 TAKO42-
Autojonizacija vode: H2O → H+ + OH- ili 2 sata2O → H3O+ + OH-
Imajte na umu da je jedini postojeći kation H.+, pa će on trpjeti smanjenje (dobitak od elektroni) na negativnoj elektrodi (katodi) i stvorit će plin vodikO (H2).
Kad smo već kod aniona, u sredini su dva aniona, a to su OS42- i oh-. Kao što pokazuje gornja tablica, OS42- reaktivniji je i manje ga je lako isprazniti. Dakle, OH- će se isprazniti, oksidirajući (gubeći elektrone) u pozitivnoj elektrodi (anodi) i proizvest će plin kisik(O2):
Polureakcija katode: 4 H3O+ + 4 i- → H2O + H2
Polureakcija anode: 4 OH- → 2 h2O + 1 O2 + 4 i-
Zbrajanjem cijelog ovog postupka dolazimo do globalne jednadžbe:
Jonizacija vode: 8 H2O → 4 H3O+ + 4 OH-
Polureakcija katode: 4 H3O+ + 4 i- → 4 h2O + 2H2
Polureakcija anode: 4 OH- → 2 h2O + 1 O2 + 4 i-
Globalna jednadžba: 2H2O → 2 H2 + 1 O2
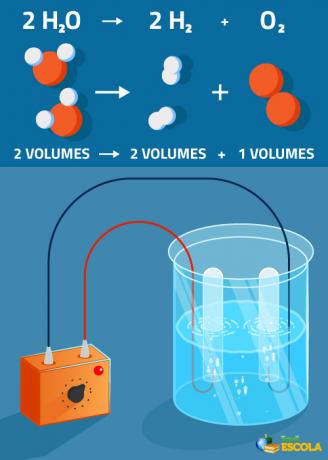
Imajte na umu da je količina proizvedenog vodika dvostruko veća od količine kisika. Međutim, u praksi taj strogi omjer nije provjeren jer je kisik topljiviji od plina vodik.
Pročitajte i vi: Dobivanje aluminija elektrolizom
Primjene elektrolize vode
Elektroliza vode vrlo je važan proces, s obzirom na to da je vodik plin koji se može koristiti kao gorivo. Poput goriva dobivena iz nafte nisu obnovljivi, plin vodik mogao bi postati važna alternativa.
Uz to, već postoje metode proizvodnje benzina koje koriste postupak elektrolize vode. Pogledajte kako se to radi u tekstu Znanstvenici su u stanju transformirati ugljični dioksid u benzin.
Napisala Jennifer Fogaça
Učitelj kemije
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Elektroliza vode"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/eletrolise-agua.htm. Pristupljeno 28. lipnja 2021.
Kemija

Primjene elektrolize, galvanizacije, niklovanja, kromiranja, nikla, kroma, katode, natrija, aluminija, klora, kaustična soda, plinoviti vodik, magmatska elektroliza, vodena elektroliza, alkalni metali, zemnoalkalna zemlja, plin klor.
Kemija

Elektroliza, otopine elektrolita, električna struja, reakcije redukcije oksidacije, spontani kemijski postupak, kemijski postupak nespontan, transformator, umjetna transformacija, industrije, alkalni metali, zemnoalkalna zemlja, plinoviti vodik, plin kl

