Elementi obitelji 17 ili VII A Periodnog sustava nazivaju se halogenima, predstavljenim s pet dolje navedenih elemenata: Fluor (F), klor (Cl), brom (Br), jod (I) i Astatin (At). Često su generički predstavljeni slovom X.

Najvažniji su, zbog njihove svakodnevne primjene, klor, brom i jod.
Ovaj naziv "halogen" znači "stvaranje soli".
Svi oni imaju 7 elektrona u valentnoj ljusci (elektronička ljuska najudaljenija od jezgre i energičnija). Općenito: ns2 np5. Kao rezultat, oni teže primati elektron i stvarati negativne monovalentne ione (X-1), reagirajući uglavnom s alkalnim metalima (metali obitelji 1) koji teže doniranju elektrona. Tako nastaju spojevi s formulama tipa MX.

Dobivanjem ovog elektrona halogeni su stabilni, jer je njihova valentna ljuska cjelovita (s osam elektrona) i njihove se karakteristike u potpunosti mijenjaju. Na primjer, plinoviti klor (Cl2) je zelenkasto-žuti, gusti, vrlo toksičan i reaktivan plin, teško topljiv u vodi i eksplozivno reagira s vodikom. Međutim, kad klor (Cl) prima elektron iz natrija (Na), oni postaju ioni, tvoreći natrijev klorid (NaCl) ili kuhinjsku sol, koju unosimo svakodnevno i koja je neophodna za održavanje našeg života. Klor posebno postaje kloridni ion (Cl
-) koja je u našem tijelu neophodna za stvaranje solne kiseline (HCl), glavne komponente našeg želučanog soka.Zapravo je klor najzastupljeniji od halogena i koristi se u proizvodnji organskih spojeva, anorganske proizvode, u proizvodnji papira (s ciljem izbjeljivanja celuloze) i u vodi i kanalizacija. Također je uobičajeno koristiti vodenu otopinu natrijevog hipoklorit (NaClO), koja se naziva "tekući klor" i koja je u sastavu izbjeljivača.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Zanimljiva je činjenica da iako neki kažu da se "čvrsti klor" koristi u bazenima, to zapravo nije samo element klor, već kalcijev hipoklorit (Ca (ClO)2).
Također, sličan slučaj je i upotreba fluor - što zapravo nije fluor, već fluoridi (ionski spojevi koji sadrže element fluor) - u tretmanu pitke vode i u proizvodima za oralnu njegu.
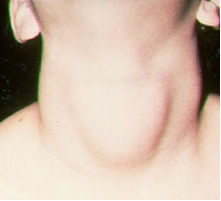
S obzirom na jod, važna primjena je njihov dodatak (u obliku jodida ili natrijevih i kalijevih jodata), zakonom propisan, kuhinjskoj soli. To je zato što nedostatak joda u tijelu može uzrokovati bolest koja se naziva gušavost, u narodu poznata kao papo.
O brom to je crvena tekućina, sobne temperature, gusta i nestabilna, a hlapljiva može ispariti stvarajući crvenkastu paru. U prirodi se ne nalazi izolirano, niti se koristi u industriji na ovaj način. Glavne primjene njegovih spojeva su: kao katalizatori za organske reakcije, pomiješani s gorivima, među ostalim u fotografskom razvoju.
već ono astatin to je radioaktivni element. Njegovo je podrijetlo obično rezultat radioaktivnog raspada izotopa urana i torija. Stvara najmanje 20 izotopa, pri čemu je At-210 najstabilniji, s poluvijekom od 8,3 sata. To je vrlo rijedak element.
Napisala Jennifer Fogaça
Diplomirao kemiju


