Reakcije sulfoniranja u alkanima oni su reakcije organske supstitucije, izvedena s ciljem proizvodnje sulfonske kiseline (organski spojevi koji imaju SO skupinu3H spojen na atom ugljika ili na ugljikov lanac) i vodu (H2O).
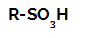
Strukturna formula sulfonske kiseline
Za provođenje reakcije sulfonacije na alkani, moramo pomiješati alkan (spoj nastao ugljikovim lancem zasićenim samo atomima ugljika i vodika) i sumporne kiseline (H2SAMO4) koncentrirana, podvrgnuta zagrijavanju (∆).
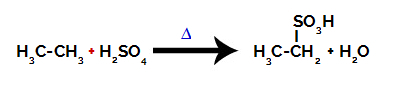
Kemijska jednadžba koja predstavlja sulfonaciju alkana s dva ugljika
Principi reakcije sulfoniranja u alkanima
Kao što su reakcija sulfoniranja alkana to je reakcija supstitucije, u njoj imamo razmjenu između manjih komponenata elektronegativnost reaktanata, odnosno između alkana i sumporne kiseline. Alkan ima vodik i sumpornu kiselinu, sulfonsku skupinu.
Ispod imamo korak po korak mehanizma a reakcija sulfonacije u alkanima. Kao primjer upotrijebit ćemo najjednostavniji alkan, metan (CH4):
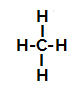
Strukturna formula metana
1. korak: Prekid veze između hidroksila (OH) i sumpora (S) u sumpornoj kiselini.
Svaka hidroksilna skupina prisutna u sumpornoj kiselini karakterizira to što je više elektronegativna. Zagrijavanjem tijekom reakcije tendencija je da se veza između hidroksilne skupine i sumpora prekine:
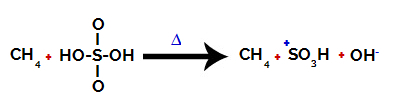
Prekid veze sumpora i hidroksila
Međutim, do prekida veze svih hidroksila ne dolazi zbog elektroničkog preslagivanja u strukturi. Tada se dobiva hidroksid anion (OH).-) i sulfonski kation.
2. korak: Napad hidroksilne skupine na molekulu alkana.
Tada hidroksi skupina (OH-) vrši napad na alkan uzrokujući prekid veze između ugljika i vodika (koji je krhkiji zbog razlike u elektronegativnosti među njima).
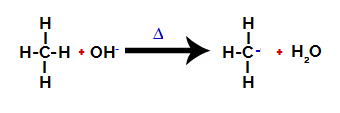
Prekidanje veze između ugljika i vodika u alkanu
Bilješka: Prekid veze između ugljika i vodika uvijek će se najčešće događati na ugljiku manje elektronske gustoće ili naboja. Što manje ugljikovih vodika ima ugljikovodik ili je više skupina vezano uz njega, to je njegova elektronska gustoća manja. Tako imamo:
Tercijarni ugljik
Nakon prekida veze alkan postaje ugljik s nedostatkom elektrona (karbokacija). Hidroksidna skupina (OH)-) u interakciji s oslobođenim vodikom i stvara molekulu vode.
3. korak: Napad nastalog radikala na sulfonsku skupinu.
Na kraju, ostatak alkana napada sulfonsku skupinu, tvoreći sulfonsku kiselinu.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
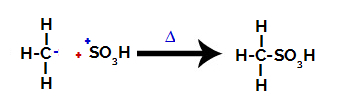
Strukture koje međusobno djeluju i tvore sulfonsku kiselinu
Primjeri jednadžbi koje predstavljaju reakcije sulfonacije u alkanima
1. primjer: Sulfoniranje propana.
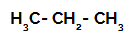
Strukturna formula propana
Propan ima dva primarna ugljika i jedan sekundarni ugljik, koji imaju različita naboja jer su povezani s različitim količinama vodika. Budući da je ugljik elektronegativniji od vodika, ti ugljikovi imaju različitu elektronsku gustoću.
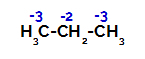
Raspodjela naboja na svakom ugljikovom atomu propana
Na primarnim ugljicima naboj je -3 (jer je vezan na tri vodika), a na sekundarnom ugljiku naboj -2 (jer je vezan na dva vodika). Dakle, doći će do prekida veze između ugljika i vodika, ponekad na ugljiku 1 (jedne molekule), ponekad na ugljiku 2 (druge molekule).
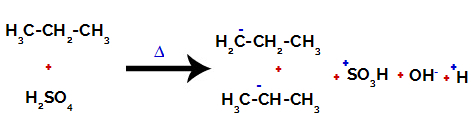
Prekidanje veze između ugljika i vodika na različitim ugljikovima
Nakon prekida između veza, kako u sumpornoj kiselini, tako i u alkanu, dolazi do stvaranja proizvodi s zamjenom vodika na ugljiku 1 sulfonskom skupinom, a isto se događa i na ugljiku 2.
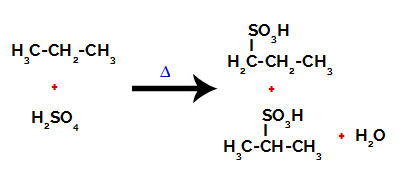
Proizvodi nastali sulfoniranjem propana
2. primjer: Sulfoniranje 2-metil-butana.

Strukturna formula 2-metil-butana
2-metil-butan ima tri primarna ugljika, sekundarni ugljik i tercijarni ugljik, koji imaju različiti naboji i, shodno tome, različite elektroničke gustoće, što se može vidjeti u sljedećoj strukturi:
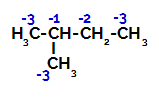
Raspodjela elektroničkih naboja u 2-metil-butanu
Stoga u 2-metil-butanu postoji nekoliko mogućnosti za razbijanje veze između ugljika i vodika, koji se mogu pojaviti na ugljiku 1 (molekule), ugljiku 2 (druge molekule), ugljiku 3 ili ugljiku 4. Međutim, vrijedno je napomenuti da su poremećaji na ugljiku broj 2 češći.
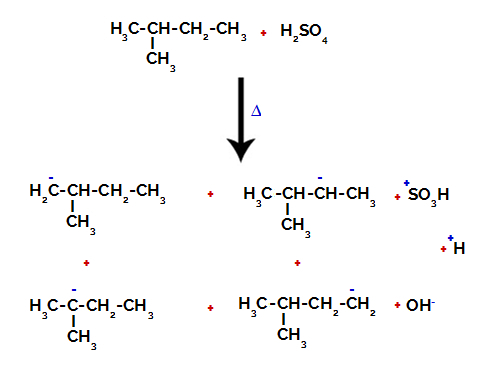
Prekidanje veze između ugljika i vodika na različitim ugljikovima
Nakon prekida između veza, kako u sumpornoj kiselini, tako i u alkanu, nastaje proizvodi s zamjenom vodika na ugljiku 1 sulfonskom skupinom, a isto se događa na ugljik 2.

Proizvodi nastali sulfoniranjem 2-metil-butana
Ja, Diogo Lopes Dias
Želite li uputiti ovaj tekst u školu ili u akademsko djelo? Izgled:
DANI, Diogo Lopes. "Reakcije sulfoniranja u alkanima"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm. Pristupljeno 28. lipnja 2021.