THE solni most je predložio engleski kemičar Frederic Daniell, 1836. godine, kada je ovaj učenjak osnovao baterija nazvana po njemu (Danilova gomila). ovaj most je cijev u obliku slova U koja ima dva porozna kraja. (sastoji se od pamuka ili agar-agara) i sadrži vodenu otopinu koju tvore voda i sol. Posredno povezuje otopine dviju polustanica stanice (anoda i katoda).
Promatranje: Anoda je negativni pol akumulatora i tu se događa oksidacija, a katoda je pozitivni pol i tamo gdje dolazi do redukcije.
Da bi se shvatila važnost slanog mosta, u početku je potrebno razumjeti kako stog radi. Pogledajte donji dijagram:
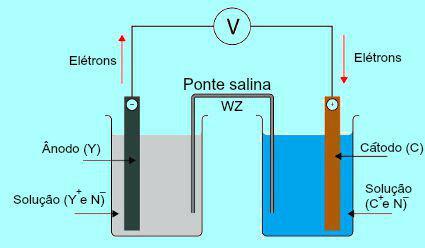
Općenita shema Daniell stoga
U početku se metal (Y) ploče prisutne u anodi podvrgava oksidaciji. Tijekom oksidacije, metal se pretvara u kation, koji pada u otopinu u kojoj je ploča. Iz tog razloga anodna otopina počinje pokazivati veću koncentraciju kationa (Y+). U tom se slučaju opaža smanjenje metalne ploče anode.
Y → i- + Y+
Zatim, elektroni izgubljeni tijekom oksidacije metala anodne ploče putuju kroz vanjsku električnu žicu i odlaze do metalne ploče prisutne u katodi. Dakle, ploča prisutna na katodi postaje nabijena elektronima.
-
Sadašnji kationi (C+) u otopini kreću se prema katodnoj ploči jer je nabijena elektronima. Kad dobivaju elektrone prisutne u ploči, kationi postaju neutralni (stabilni i čvrsti) i prianjaju uz nju. Iz tog razloga otopina katode predstavlja veću koncentraciju aniona nego kationa. U tom se slučaju primjećuje povećanje veličine metalne ploče s katodom.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Ç+ + i- → C
Iz razumijevanja kako Danielova hrpa, moguće je primijetiti da otopina prisutna u anodi prima veću količinu Y kationa+ zbog oksidacije metala X ploče. S druge strane, otopina prisutna u katodi gubi svoje katione (C+) jer pate od smanjenja plaka.
Upravo je po ovom pitanju istaknut rad slanog mosta. Glavna funkcija ovog mosta je promicanje ravnoteže naboja prisutnih u anodnim i katodnim otopinama. U solnom mostu uvijek imamo sol (obično kalijev klorid ili amonijev nitrat.) Disociranu u vodi. Pogledajte prikaz jednadžbe u mostu soli:
WZ + H2O → W+ + Z-
U mostu soli nalaze se dva iona (W+ i Z-), koji su pomaknuti na katodu i anodu prema:
The) Anoda prima anione (Z-) prisutan u solnom mostu zbog oksidacije elementa (Y), što uzrokuje povećanje količine kationa (Y+) u otopini.
B) Katoda prima katione (W+) solnog mosta jer je tijekom rada na bateriji kation (C+) prisutna u otopini smanjena je na ploči. Dakle, otopina katode ima veću količinu aniona (N-) i stoga prima kation prisutan u mostu soli.
Ja, Diogo Lopes Dias
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
DANI, Diogo Lopes. „Jedrinski most“; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. Pristupljeno 28. lipnja 2021.

