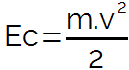THE ebulioskopija, jedan od četiri koligativna svojstva, proučava ponašanje točke vrenja a otapalo prilikom primanja jednog otopljeni nehlapljiv. Ostala koligativna svojstva su tonoskopija, krioskopija i osmoskopija.
Napomena: Nehlapljiva otopljena tvar je svaka tvar koja ima visoku vrelište i nisko talište i sposobno za otapanje u određenom otapalu.
Općenito govoreći, kada se otapalu doda nehlapljiva otopljena tvar, otežava isparavanje otapala. Dakle, potrebna je viša temperatura da bi otapalo moglo ispariti. Na ebulioskopija, proučava se ovo povećanje vrelišta otapala.
Ova poteškoća uzrokovana otopljenom supstancom u isparavanju otapala, odnosno porastom točke ključanja otapala, izravno je povezana s vrstom otopljene tvari koja je prisutna u otopini. Moguće vrste otopljene tvari su:
Jonska otopljena tvar: kad se doda u vodu, jonizovati ili se disocira, napuni otopinu ionima. Primjeri: sol, baza, kiselina.
molekularna otopljena tvar: kad se doda u vodu, ne ionizira se zadržavajući molekularni oblik. Primjeri: glukoza, saharoza.
Što je veći broj čestica u otapalu, to je intenzivnije ebulioskopija, odnosno što je veće vrelište otapala. Dakle, u ionskim otopinama točka vrenja vode obično je veća od točke vrelišta molekularnih otopina, sve dok su u istoj koncentraciji.
Formule korištene u izračuni ebulioskopije
Za izvođenje proračuna ebulioskopija, imamo sljedeće formule:
Formula za izračunavanje varijacije temperature ključanja
Δte = t-t2
U ovoj formuli izračunavamo varijaciju temperature vrenja oduzimanjem temperature ključanja otapala u otopini od temperature ključanja čistog otapala.
Napomena: Skraćenica Δte također se može nazvati povišenjem točke ključanja otapala.
Formula za izračunavanje porasta temperature ključanja koja uključuje molalnost
Δte = Ke. W
To je formula koja će se koristiti, ovisi o poznavanju konstante ebulioskopije, koja je povezana s otapalom prisutnim u otopini, i molalnošću (W). Svaka od ovih varijabli ima određenu formulu.
Van't Hoffov korekcijski faktor (i) također se može pojaviti u ovoj formuli, međutim, samo ako je prisutna nehlapljiva otopljena tvar ionska.
Δte = Ke. W.i
Napomena: Da biste utvrdili Van't Hoffov korekcijski faktor, potreban nam je stupanj ionizacije ili disocijacije otopljene tvari i broj čestica (q) ioniziranih ili disociranih otopljenom supstancom kada su prisutne u vodi.
Formula za izračunavanje ebuliskopske konstante (Ke)
Ke = RT2
1000.Lv
U ovoj formuli imamo opću plinsku konstantu (0,082), temperaturu (uvijek se radi u kelvinima) i latentnu toplinu isparavanja.
Formula za izračunavanje molalnosti (W)
W = m1
M1.m2
U ovoj se formuli koristi masa otopljene tvari (m1 - uvijek se radilo u gramima) molarne mase otopljene tvari (M1) i mase otapala (m2 - uvijek radio u kilogramima).
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Napomena: Iz poznavanja formule molalnosti, ako zamijenimo W, prisutan u Δte-ovoj formuli, odgovarajućom formulom, dobit ćemo sljedeći rezultat:
Δte = Ke.m1
M1.m2
Primjer primjene formula u izračunu ebulioskopije
1. primjer - (Uece) Prateći stope francuskog kemičara François-Marie Raoulta (1830. - 1901.), istražujući ebuliometrijski učinak otopina, student kemije otopio je 90 g glukoze (C6H12O6) u 400 g vode i grijao cijelu. Znajući da je Ke u vodi = 0,52 ºC / mol, nakon nekog vremena početna temperatura vrenja koju je pronašao bila je: (Podaci: Molarna masa glukoze = 180 g / mol)
a) 99,85 ° C.
b) 100,15 ° C.
c) 100,50 ° C.
d) 100,65 ° C.
Podaci dobiveni vježbom:
m1= 90 g;
m2 = 400 g ili 0,4 kg (nakon dijeljenja sa 1000);
Ke = 0,52;
M1 = 180 g / mol;
t =? (početna temperatura vrenja ili temperatura ključanja otapala u otopini).
Napomena: Temperatura ključanja vode (t2) je 100 OÇ.
Kako je vježba osigurala mase i konstantu ebulioskopije, samo upotrijebite podatke u donjem izrazu:
t-t2 = Ke.m1
M1.m2
t-100 = 0,52.90
180.0,4
t-100 = 46,8
72
t-100 = 0,65
t = 0,65 + 100
t = 100,65 OÇ
2. primjer - (Uece) Kalcijev klorid (CaCl2) ima široku industrijsku primjenu u rashladnim sustavima, proizvodnji cementa, koagulaciji mlijeka za proizvodnju sira i izvrsno se koristi kao regulator vlage. Otopina kalcijevog klorida koja se koristi u industrijske svrhe ima molalnost 2 i vrelište 103,016 ° C pod tlakom od 1 atm. Znajući da je konstanta ebulioskopije vode 0,52 ° C, njezin prividni stupanj ionske disocijacije je:
a) 80%.
b) 85%.
c) 90%.
d) 95%.
Podaci dobiveni vježbom:
- Ke = 0,52;
- W = 2 mola;
- t = 103,016 (početna temperatura ključanja ili temperatura ključanja otapala u otopini).
Napomena: Temperatura ključanja vode (t2) je 100 OÇ.
Kako su vježbom dani podaci o ebulioskopiji, poput Ke i molalnosti, očito je da bismo trebali koristiti sljedeću formulu za ebullioskopiju:
Δte = Ke. W
Međutim, kako vježba traži stupanj disocijacije, gornju formulu moramo raditi s Van't Hoffovim korekcijskim faktorom (i):
Δte = Ke. W.i
Također, da biste izračunali stupanj, morat ćete zamijeniti i njegovim izrazom, koji je 1 + α. (Q-1):
t-t2 = Ke. Š [1 + α. (Q-1)]
103,016-100 = 0,52.2.[1+ α.(3-1)]
3,016 = 1,04.[1+ 2 α]
3,016 = 1,04 + 2,08α
3,016 – 1,04 = 2,08α
1,976 = 2,08α
1,976 = α
2,08
α = 0,95
Na kraju, samo pomnožite pronađenu vrijednost sa 100 da biste odredili postotak:
α = 0,95.100
α = 95%
Ja, Diogo Lopes Dias