Velika većina materijala koji se nalaze u prirodi, našem društvu i tijelima nisu čiste tvari, već zapravo smjese od dva ili više tvari.
Iako se većinu vremena na mineralnu vodu pozivamo samo kao na „vodu“, ona u stvarnosti ne sadrži samo čistu tvar H2O, jer je rezultat procesa u kojem kišnica prodire u tlo i prolazi kroz razne stijene.
Dakle, kako mu samo ime govori, osim vode ima i nekoliko otopljenih minerala. Ako ste znatiželjni provjeriti oznaku bilo koje mineralne vode, vidjet ćete da ona ima svoj sastav kemija stroncijevi sulfati, kalcij, natrij, kalij, natrij bikarbonat, natrij fluorid, među drugi.
Mapa uma: Mješavine
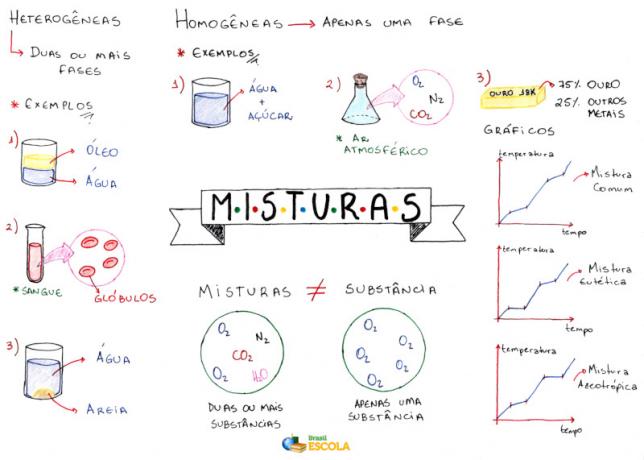
* Za preuzimanje mape uma u PDF-u, Kliknite ovdje!
Kako je moguće razlikovati tvar od smjese?
Destilirana voda dolje prikazana čista je tvar koja sadrži samo H2O:

Destilirana voda koja se koristi u laboratoriju
Vizualno izgleda točno poput mješavine vode i soli; međutim, mogu se razlikovati od definicije smjese. Izgled:
→ Smjese su materijali čija fizikalna svojstva nisu stalna, već se razlikuju pri određenoj temperaturi i tlaku.
Dakle, samo izmjerite fizička svojstva, poput tališta i vrelišta i gustoće. Ako su stalni i dobro definirani, to je a čista tvar (u slučaju destilirane vode, na 4 ° C, njena gustoća je 1,0 g / cm3 a na razini mora točke topljenja i vrelišta su 0 ° C, odnosno 100 ° C).
Međutim, ako su predstavljene varijacije, to je smjesa. Ako zagrijete smjesu vode i soli kako biste provjerili točku vrenja, vidjet ćete to tijekom promjene iz tekućeg stanja u plina, temperatura ne ostaje konstantna, kao kod destilirane vode, koja ostaje na 100 ° C dok se sva tekućina ne okrene para.
Sada ih ima smjese da čak nije potrebno utvrđivati njihova fizička svojstva da bi se znalo da su smjese, samo pogledajte, kao što je slučaj sa sljedećom smjesom vode i ulja:

Smjesa koju tvore voda i ulje
To ukazuje na to da postoje različite vrste smjesa koje se mogu klasificirati homogeni i heterogeni. Pogledajte svaki:
Homogene smjese:
Oni su oni koji imaju jednolik izgled, s jednom fazom (jednofazna). Primjeri:
fiziološka otopina (0,9 g natrijevog klorida u 100 ml vode);
salamura (36 g soli kao što su natrijev klorid, magnezijev klorid, kalijev jodat, antihumektanti i 100 ml vode);
hidratirani alkohol (etanol i voda);
zrak (78% dušika, 20% plina kisika, 2% ostalih plinova i vodene pare);
čelik (metalna legura nastala od 98,5% željeza i 1,5% ugljika).

Fiziološka otopina, čelik i formaldehid, primjeri homogenih smjesa
Gornji primjeri to pokazuju homogene smjese mogu biti u krutom, tekućem ili plinovitom stanju. Te homogene smjese se nazivaju rješenja i ne mogu se razdvojiti fizikalnim metodama, već samo kemijskim tehnikama. Na primjer, da biste odvojili alkohol od vode, potrebno je provesti postupak destilacija, jer a centrifuga ili filtracija ne bi uspjelo.
Uz to, važno je naglasiti da to moraju biti homogena čak i kad se gleda pod ultramikroskopom. Golim okom, mlijeko i krv, na primjer, mogu izgledati homogeno, ali pod ultramikroskopom vidimo da su, u stvari, heterogena. Pogledajte sliku krvi ispod ultramikroskopa i njegove zasebne faze nakon što je stavljena u ultracentrifugu:
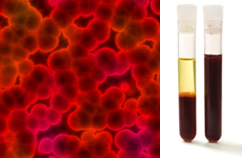
Mikroskopska slika i faze krvi
Heterogene smjese:
Jesu li oni koji imaju više od jedne faze. Primjeri: voda i ulje, voda i pijesak, led i voda, granit, voda i željezo, nerastvorena sol u vodi itd.
Komponente heterogene smjese pojavljuju se, u većini slučajeva, u različitim fizičkim stanjima i mogu se razdvojiti fizikalnim metodama. Primjer se događa kada skuhamo kavu i filtriramo krutinu, odvajajući je od tekućine.
Ali to se ne događa uvijek, kao što je prikazano u slučaju ulja i vode, koje se, iako su obje tekućine, ne otapaju zbog različitih polariteta njegovih molekula.
Mentalna karta Majka Victor Ricardo Ferreira
Učitelj kemije
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/tipos-misturas.htm


