Da bi se kemijska reakcija dogodila potrebno je zadovoljiti četiri osnovna uvjeta, a to su:
1. Reagensi moraju kontaktirati;
2. Između reagensa mora postojati kemijski afinitet;
3. Sudari između čestica reagensa moraju biti učinkoviti;
4. Mora se postići energija aktivacije.
Ukratko pogledajte svaki slučaj:
1.Kontakt između reagensa:
Ovo je stanje očito, jer čak i ako reaktanti imaju puno afiniteta jedni za druge, kao u slučaju kiselina i baza, ako se odvoje, reakcija se neće dogoditi. Moraju doći u kontakt kako bi se njihove čestice mogle sudariti, prekidajući veze reaktanata i stvarajući veze proizvoda.

2.Kemijski afinitet:
Kao što smo vidjeli, dovođenje reagenasa u kontakt je neophodno, ali nedovoljno. Na primjer, ako stavimo natrij u kontakt s vodom, dogodit će se izuzetno burna reakcija, ali ako stavimo zlato, nećemo vidjeti nikakvu razliku. To je zato što različite tvari međusobno imaju različite kemijske afinitete ili možda uopće nemaju afiniteta. Što je veći kemijski afinitet, reakcija je brža.
U spomenutim primjerima natrij ima velik afinitet s vodom, toliko da metalni natrij, kako ne bi došao u kontakt s vlagom u zraku, čuva u kerozinu. Zlato je inertno, zbog čega spomenici zlata traju toliko dugo, poput egipatskih sarkofaga.

3.Teorija sudara:
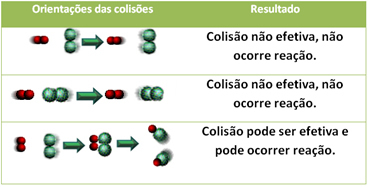
Čak i u spojevima koji imaju kemijski afinitet, za reakciju je potrebno da se njihove čestice, atomi ili molekule učinkovito sudare. Nisu sve čestice koje se sudaraju to čine učinkovito, ali udarci koji rezultiraju razbijanjem reagenske veze i stvaranje novih veza su one koje se javljaju u pravilnoj orijentaciji i s energijom dovoljno.
Dolje je prikazan slučaj dva neučinkovita sudara i jednog djelotvornog sudara koji rezultiraju reakcijom.
4.Aktivacijska energija i aktivirani kompleks:
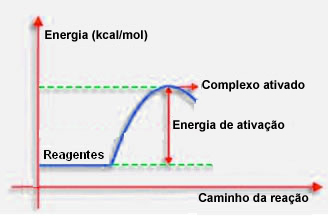
Kao što je rečeno u prethodnoj točki, za učinkovit sudar, osim povoljnih smjernica, potrebna je i dovoljna energija. Minimalna količina energije potrebna za svaku reakciju koja se odvija naziva se energija aktivacije.
Ako reaktanti imaju energiju jednaku ili veću od energije aktiviranja, tijekom dobro orijentiranog šoka, stvorit će se inicijalno aktivirani kompleks, koji je srednja struktura između reaktanata i tvari proizvoda. U aktiviranom kompleksu dolazi do oslabljenih veza reagena i stvaranja veza novih proizvoda.
Dakle, energija aktivacije djeluje kao vrsta zapreke za nastanak reakcije, jer što je veća, to će biti teže da se reakcija dogodi. U nekim je slučajevima potrebno reagense opskrbiti energijom. Na primjer, plin za kuhanje ima afinitet za interakciju s kisikom u zraku, ali moramo opskrbiti energijom kad spojimo šibicu, inače se reakcija ne dogodi. Ali kad jednom započne, sama reakcija oslobađa dovoljno energije da aktivira ostale molekule i održi reakciju.
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm