Na intermolekularne sile, generički nazvan Van der Waalsove snage, postoje tri: inducirani dipolom inducirani dipol, vodikove veze i trajni dipol-trajni dipol. U ovom ćemo tekstu razmotriti samo posljednju od ove tri sile:
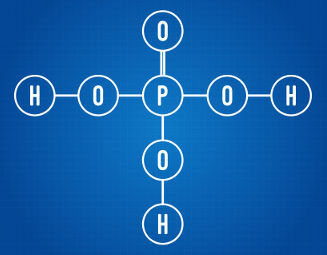
Snaga trajni dipol-trajni dipolili jednostavno dipol-dipol javlja se samo u polarne molekule, odnosno oni koji nemaju ravnomjernu raspodjelu opterećenja duž njegove površine. Da navedemo primjer, u molekuli HCl (klorovodični plin) elektronički oblak je više pomaknut prema atomu klora, jer je elektronegativniji od vodika.

Imajte na umu da oko atoma klora dolazi do nakupljanja elektrona, što uzrokuje stvaranje a negativan pol, što simbolizira grčko slovo delta (-δ). Kao rezultat, u regiji oko atoma vodika a pozitivni pol (+δ), jer ima malu elektroničku gustoću. Tada molekula HCl tvori a električni dipol i, prema tome, kada dolaze u kontakt s drugim susjednim molekulama HCl, postoji sila privlačenja između suprotnih polova molekula, kao što se može vidjeti dolje:

Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Ova privlačna sila, koja se uspostavlja između negativnog kraja dipola jedne molekule i pozitivnog kraja dipola druge molekule, čini dipol-dipolnu silu..
Dakle, kao što i samo ime kaže, dipol je trajan, pa se javlja samo u polarnim spojevima. I što je polaritet molekule veći, to su dipol-dipolne interakcije u tvari intenzivnije.
Ako je u čvrstoj fazi, stvaranje trajnog dipola vodi položaj svake molekule u prostoru, formirajući se dipolarni kristali; kao u slučaju vodikovog bromida prikazanog u nastavku:

Ostali primjeri polarnih tvari koje imaju dipol-dipolnu snagu između svojih molekula su: H2S, CO, HCCl3, SAMO2.
Ova intermolekularna sila je od srednjeg intenziteta, jer je jača od inducirane dipol-inducirane sile privlačenja dipola, ali manje intenzivna od vodikove veze. Zbog toga su njihova tališta i vrelišta veća od onih u tvari koje imaju induciranu dipolnu čvrstoću. Kako je trajna dipolna sila jača, potrebno je opskrbiti se više energije da bi se interakcije njegovih molekula razbile.
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Dipol-dipolna intermolekularna sila"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm. Pristupljeno 27. lipnja 2021.
e) OS2, HBr, HCl, H2O.
c) Znajući da su temperature vrenja CH3Cl i CH3I je 24,0 ° C, odnosno 42,4 ° C, ukazuje koji spoj u tekućoj fazi predstavlja intenzivnije intermolekularne sile.