THE konstanta hidrolize (Kh) odnosi se na a kemijska ravnoteža utvrđena hidrolizom soli (kemijska reakcija koja uključuje topljivu sol i vodu).
Kao konstanta bilo koje druge ravnoteže, izraz konstanta hidrolize konstruira se od proizvoda koncentracija proizvoda podijeljenog s proizvodom koncentracije reagensa, kako slijedi:
Kh = [proizvodi]
[reagensi]
Rad s konstantom hidrolize uključuje poznavanje tri važna fenomena:
- Disocijacija soli;
- Jonizacija vode;
- Hidroliza soli.
Disocijacija soli
Kad se u vodu doda topljiva sol, ona se disocira i oslobađa kation koji nije hidronij (H +) i anion koji nije hidroksil (OH-).

Da vas podsjetimo kada je sol topljiva u vodi ili nije, Kliknite ovdje i proučiti tablicu topljivosti soli.
jonizacija vode
Voda je tvar koja prirodno prolazi pojavu samoionizacije, odnosno stvara hidronijev kation i hidroksilni anion.
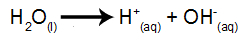
jednadžba jonizacije vode
hidroliza soli
Kao topljiva sol oslobađa ione u vodu i voda prolazi kroz ionizaciju, stvarajući ioni u sredini se može odvijati reakcija (hidroliza) između solnih iona i vodenih iona. Kada se ova reakcija dogodi, moguće interakcije su:
- Kation soli s anionom vode (stvaranje baze);
- Anion soli s kationom vode (stvaranje soli);
Gore navedene interakcije dogodit će se samo ako je baza ili kiselina koja nastaje slaba.
Pogledajte primjer hidrolize soli:
→ Hidroliza amonijevog hipoklorita (NH4ClO)
Kad se amonijev hipoklorit doda u vodu, on se otopi i disocira, oslobađajući amonijeve kation ione (NH4 +) i hipokloritni anion (ClO-):

Jednadžba koja pokazuje ione koji se oslobađaju u disocijaciji amonijeva hipoklorit
Kako voda, kad prolazi kroz ionizaciju, stvara H + i OH-, u otopini imamo dva kationa i dva aniona koji mogu reagirati. Kation NH4 + reagira samo s OH-anionom jer tvori slabu bazu (NH4OH). ClO-anion reagira samo s kationom H + jer tvori slabu kiselinu (HClO).

Jednadžba ravnoteže hidrolize amonijevog hipoklorita
Izgradnja izraza konstante hidrolize
Konstrukcija konstante hidrolize soli ovisi isključivo o jednadžbi hidrolize za tu sol. Na primjer, hidroliza amonijeva hipoklorit, obrađena u prethodnoj točki, generirala je sljedeću jednadžbu:

Jednadžba ravnoteže hidrolize amonijevog hipoklorita
Kako izgraditi izraz konstanta hidrolize uzimajući u obzir proizvode i reagense, izraz konstante bio bi:
Kh = [HClO]. [NH40H]
[ClO -]. [NH4 +]
NAPOMENA: Voda ne sudjeluje u jednadžbi jer je tekući reagens, a također i zato što je osnovno sredstvo za pojavu hidrolize, odnosno postojana je.
Ja, Diogo Lopes Dias
Izvor: Brazil škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-constante-hidrolise.htm

